Publié dans Covid19-FAQ.
#109 Que connaissons nous des vaccins de la Covid-19 à ce jour? Quelle est leur balance bénéfice-risques ?
 Cette FAQ présente de façon simple et didactique les différents aspects concernant les vaccins en général et en particulier les vaccins de la COVID-19. Elle est mise à jour de façon très régulière en fonction des nouvelles connaissances et des nouveaux résultats.
Cette FAQ présente de façon simple et didactique les différents aspects concernant les vaccins en général et en particulier les vaccins de la COVID-19. Elle est mise à jour de façon très régulière en fonction des nouvelles connaissances et des nouveaux résultats.
Dernières MAJ :
Fev 2024 (QR23 enfants et adolescents)
A noter: vous pouvez retrouver cette FAQ sur le site sante.fr , à cette adresse: https://sante.fr/coronavirus-covid-19-que-connaissons-nous-des-vaccins-de-la-covid-19-ce-jour-quelle-est-leur-balance
Données d'efficacité
L’organisation mondiale de la santé avait fixé comme objectif pour les vaccins contre la Covid une réduction minimale de 50% des infections.
Les essais chez les enfants de 5 à 11 ans montrent une efficacité des deux doses de 10 µg COMIRNATY® de 90,7% sur la survenue d’infection avec une réponse anticorps et une sécurité comparables à celles observées dans les groupes plus âgés [1L’effectivité contre le développement d’infections symptomatiques des enfants et adolescents par le variant Omicron a été ultérieurement analysée. Dans une étude d’effectivité en vie réelle du vaccin COMIRNATY® chez les adolescents entre 12 et 15 ans, le risque d’hospitalisation est réduit de 94% et le risque de passage en réanimation est réduit de 91% après une dose et de 98% après deux doses [2]. L’effectivité sur les infections à Covid-19 symptomatiques était d’environ 60% 2 à 4 semaines après la deuxième dose, et d’environ 70% après la troisième dose chez les adolescents [3].
Dans une étude menée à Singapour, chez des enfants entièrement vaccinés de 5 à 11 ans, entre 7 jours et 59 jours après la seconde dose, l'effectivité du vaccin est supérieure à 60 % sur les infections à Covid-19 confirmées par PCR et à 80% % sur les hospitalisations [2].
Ces données sont cohérentes avec une étude américaine où la vaccination par deux doses de COMIRNATY® réduit de deux tiers le risque d'hospitalisation associé au variant Omicron chez les enfants âgés de 5 à 11 ans [4].
Une dose de rappel vaccinal COMIRNATY® permet de prolonger et maintenir une effectivité de plus de 50% sur les infections avec un effet persistant à 3 mois [5].
Une méta-analyse incluant les enfants de 5 à 11 ans montre que les deux doses de vaccin à ARNm permettent à la fois de diminuer le risque de développer une infection à SARS-CoV-2 symptomatique ou asymptomatique (OR=0.47, IC95% 0.35-0.64), ses symptômes (OR=0.53, IC95% 0.41-0.71) mais aussi l’hospitalisation due à cette infection (OR=0.32, IC95% 0.15-0.68). Ces deux doses de vaccin à ARNm réduisent également le risque de développer un syndrome inflammatoire multi-systémique (OR=0.05, IC95% 0.02-0.10) [6].
Dans une étude de cohorte menée en Californie une troisième dose du vaccin à ARNm (booster) réduit le risque de passage aux urgences associé à une infection à Omicron de 77% (IC à 95% 53-88) chez les enfants âgés de 5 à 11 ans [7].
Dans une méta-analyse de 2023 menée auprès des 12-17 ans, l’efficacité des deux doses cumulées du vaccin Pfizer BNT162b2 était de 82,7% (IC à 95% : 78,37-87,31%) sur les cas de Covid-19 confirmée par PCR. Le vaccin est efficace contre les variants Omicron, Delta, Alpha et Gamma ; en particulier contre les formes sévères en avoisinant une efficacité de 88% tandis qu’elle est de 35% contre les formes non sévères. A noter le déclin de l’efficacité au cours du temps corroborant les multiples données justifiant une dose booster efficace à 73% pour le vaccin Pfizer contre les formes nécessitant une hospitalisation durant la période de circulation du variant Omicron [8].
De récentes données issues d’un réseau de surveillance vaccinale américain (New Vaccine Surveillance Network) couvrant les enfants admis dans des services d’urgence pour une infection respiratoire aiguë mettent en évidence une effectivité de près de 40% (IC 95% 8-60%) après deux doses du vaccin par ARNm pour prévenir le passage aux urgences ou une hospitalisation après infection par le SARS-CoV-2 chez les 6 mois-5 ans (9).
Données de sécurité
Des études de pharmacovigilance (voir la QR#153 pour la définition) sont en cours pour identifier les événements rares.
Aux USA, les résultats publiés par le Centers for Disease Control and Prevention (CDC) [10] concernant 8,7 millions de doses administrées à des enfants âgés de 5 à 11 ans sont rassurants.
En effet, 97,6% des effet indésirables rapportés étaient « non graves » (fièvres, douleur au point d’injection, douleur musculaire, …), et ces effets étaient moins fréquents chez les 5-11 ans que chez les adolescents.
Ces données sont cohérentes avec la méta-analyse de Watanabe et al, qui montre que la plupart des enfants développaient seulement des effets indésirables locaux, les effets indésirables graves étaient rares et la plupart des effets indésirables résolus en quelques jours. D’autre part, les effets indésirables, qui ont empêché la réalisation d’actes de la vie quotidienne ont été observées chez 4,9 % (IC à 95 %, 3,1 - 7,7 %) et 8,8 % (IC à 95 %, 5,4-14,2 %) des enfants vaccinés après les premières et deuxièmes injections, respectivement.. Fait important, le risque de développer une myocardite après l'infection par le SARS-CoV-2 est supérieur à celui causé par le vaccin à ARNm.
Cette méta-analyse conclut aussi que le pronostic d’un syndrome inflammatoire multisystémique induit par l’infection de SARS-CoV-2 est susceptible d’être plus grave que celui d’une myocardite post-vaccinale. L'effet protecteur des vaccins à ARNm contre le syndrome inflammatoire multisystémique doit être pris en compte lors de l’évaluation du rapport bénéfice/risque de la vaccination chez les enfants âgés de 5 à 11 ans [6]. De récentes données issues de réseaux de surveillance pédiatrique soulignent l’absence de risque de présenter une complication cardiaque parmi les adolescents vaccinés durant la période de circulation du variant Delta et une diminution de ce risque durant la période Omicron. Il est important de noter que plusieurs études ont objectivé une augmentation du risque de survenue de myocardite et de péricardite après une infection à SARS-CoV-2, jusqu’à 36,8 fois plus élevé (IC 25,0-48,6) chez les moins de 16 ans (15).
Les données françaises de pharmacovigilance au 14/07/2022 font état de 111 cas cumulés depuis le début de la vaccination, dont 15 rapportés sur la période du 10 juin au 14 juillet 2022, chez des enfants âgés de 5 à 11 ans, après vaccination par le vaccin COMIRNATY®. Sur ces 15 nouveaux cas, un seul cas de crise convulsive partielle d’évolution favorable a été décrit. De plus, 141 cas cumulés d’erreurs médicamenteuses ont été mentionnées dont 9,2% ayant entrainé un effet indésirable. Pour conclure, les données disponibles actuellement n’évoquent pas de signal de sécurité spécifique au vaccin COMIRNATY® dans une population d’enfants d’âge compris entre 5 et 11 ans(11).
Les enfants âgés de 6 mois à 4 ans ayant reçu le vaccin Pfizer-BioNTech ont le plus souvent présenté des effets indésirables légers à modérés. Ils étaient plus fréquemment décrits chez les nourrissons âgés de 6 mois à 2 ans. Aucun effet indésirable grave n’a été reporté (12). Les réactions les plus communes incluaient des pleurs et une douleur au point d’injection (15-73%), une fatigue (24-48%), de l’irritabilité (44-67%) (13). La survenue d’une myocardite reste rare et ce risque post-vaccination, plus élevé chez les adolescents, décroit inversement avec l’âge des enfants. Aucun cas n’a été reporté parmi les 6 mois-5 ans (12).
Recommandations françaises (mise à jour décembre 2023) (14) :
La vaccination des mineurs à risque de forme grave de Covid-19 ou proches d’une personne immunodéprimée au sein du même foyer, est recommandée. La dose administrée pour les enfants âgés de moins de 11 ans est adaptée à leur tranche d’âge :
- Enfants de 5 à 11 ans: vaccin Pfizer-BioNTech 10 µg/dose
- Enfants de 6 mois à 4 ans: vaccin Pfizer-BioNTech 3 µg/dose
Les schémas vaccinaux ont été simplifiés pour les enfants de 5 à 11 ans : quel que soit le passé vaccinal du patient, la posologie consiste en une seule dose de vaccin. Cette simplification n’est pas applicable pour la catégorie 6 mois-4 ans.
L’analyse de l’ensemble des données d’efficacité et de sécurité permettent de conclure à l’intérêt de la vaccination des enfants dans le contexte épidémique actuel
Références :
- Walter EB, Talaat KR, Sabharwal C, Gurtman A, Lockhart S, Paulsen GC, et al. Evaluation of the BNT162b2 Covid-19 Vaccine in Children 5 to 11 Years of Age. N Engl J Med. 6 janv 2022;386(1):35‑46.
- Tan, Sharon HX, et al. "Effectiveness of BNT162b2 vaccine against omicron in children 5 to 11 years of age." New England Journal of Medicine6 (2022): 525-532.
- Fleming-Dutra KE, Britton A, Shang N, Derado G, Link-Gelles R, Accorsi EK, et al. Association of Prior BNT162b2 COVID-19 Vaccination With Symptomatic SARS-CoV-2 Infection in Children and Adolescents During Omicron Predominance. JAMA https://doi.org/10.1001/jama.2022.7493
- Price, Ashley M., et al. "BNT162b2 protection against the omicron variant in children and adolescents." New England Journal of Medicine20 (2022): 1899-1909.
- Khan, Farid L., et al. "Estimated BNT162b2 vaccine effectiveness against infection with delta and omicron variants among US children 5 to 11 years of age." JAMA Network Open12 (2022): e2246915-e2246915.
- Watanabe, Atsuyuki, et al. "Assessment of efficacy and safety of mRNA COVID-19 vaccines in children aged 5 to 11 years: a systematic review and meta-analysis." JAMA pediatrics(2023).
- Tartof, Sara Y., et al. "BNT162b2 Against COVID-19-Associated Emergency Department and Urgent Care Visits Among Children 5–11 Years of Age: A Test Negative Design." Journal of the Pediatric Infectious Diseases Society3 (2023): 177-179.
- Katoto, Patrick DMC, et al. "Safety of COVID-19 Pfizer-BioNtech (BNT162b2) mRNA vaccination in adolescents aged 12–17 years: A systematic review and meta-analysis." Human Vaccines & Immunotherapeutics 18.6 (2022): 2144039.
- Tannis, Ayzsa. "SARS-CoV-2 Epidemiology and COVID-19 mRNA Vaccine Effectiveness Among Infants and Children Aged 6 Months–4 Years—New Vaccine Surveillance Network, United States, July 2022–September 2023." Morbidity and Mortality Weekly Report 72 (2023).
- Hause, Anne M., et al. "COVID-19 vaccine safety in children aged 5–11 years—United States, November 3–December 19, 2021." Morbidity and Mortality Weekly Report51-52 (2021): 1755.
- Enquête de pharmacovigilance du vaccin Pfizer – BioNTech Comirnaty, Analyse périodique n°4 : Période du 10 Juin au 14 Juillet 2022, https://ansm.sante.fr/uploads/2022/08/01/20220728-enquete-pv-vaccin-comirnaty-analyse-periodique-4-2.pdf
- Hause, Anne M., et al. "COVID-19 mRNA vaccine safety among children aged 6 months–5 years—United States, June 18, 2022–August 21, 2022." Morbidity and Mortality Weekly Report 71.35 (2022): 1115.
- Jantarabenjakul, Watsamon, et al. "Global COVID-19 vaccination in infants and children: Effectiveness, safety, and challenges." Asian Pac J Allergy Immunol 41.4 (2023): 292-303.
- https://sante.gouv.fr/soins-et-maladies/maladies/maladies-infectieuses/coronavirus/vaccin-covid-19/la-vaccination-contre-le-covid-19-tout-savoir-tout-comprendre/article/la-vaccination-contre-le-covid-19-tout-savoir-tout-comprendre
- Wu, Qiong, et al. "Real-World Effectiveness of BNT162b2 Against Infection and Severe Diseases in Children and Adolescents." Annals of Internal Medicine (2024).
L’affection post-COVID-19, ou "COVID long" sont les termes utilisés pour décrire les signes et les symptômes qui continuent ou se développent chez des patients après une infection aiguë au COVID-19. Les symptômes de l’affection post-COVID-19 peuvent persister à plus de 4 à 12 semaines de la phase aiguë du COVID-19. Ils peuvent également se manifester après un rétablissement initial et être intermittents [1].
L’affection post-COVID-19 est généralement diagnostiquée au moins 3 mois après la phase initiale de la COVID-19. Cette période de 3 mois permet d’exclure la période de rétablissement habituelle après la phase aiguë de la maladie, qui peut parfois être longue chez des patients ayant souffert d’une forme grave du COVID-19 [1].
Les symptômes courants comprennent entre autres fatigue, essoufflement, douleurs thoraciques, douleurs musculaires, difficultés de concentration et mémorisation, de l’anxiété voire même une dépression et ont généralement un impact sur la vie quotidienne. La prévalence du covid long post COVID-19 est estimée entre 8 à 30% selon les études [1,2].Plusieurs facteurs de risques ont été mis en évidence :
- Dans une méta analyse de décembre 2022 sur 860 783 patients [7] plusieurs facteurs de risque sont associés à la survenue de COVID long : le sexe féminin (OR 1,56), l’âge supérieur à 40 ans (OR 1,21), l’obésité (OR 1,15), le tabagisme (OR 1,10). Certaines comorbidités comme l’anxiété (OR 1,19), l’asthme (OR 1,24), la BPCO (OR 1,38), l’immunosuppression (OR 1,50), la maladie coronarienne (OR 1,28) sont également significatives. Enfin, L’hospitalisation en soins intensifs pour COVID est également un facteur de risque (OR 2,48).
La prévention du syndrome post COVID-19 par la vaccination a été évaluée dans plusieurs études.
- Dans une étude cas-témoins avec recueil des données prospectives, des patients vaccinés par une ou deux doses et présentant un test positif COVID-19 post vaccination étaient appariés avec des patients non vaccinés testés positifs pour le COVID-19 de décembre 2020 à juillet 2021 [3]. 31 (5,2%) des 592 patients infectés après deux doses de vaccin, et 55 (11,4%) des 482 patients infectés non vaccinés gardent des symptômes après 28 jours. Après ajustement sur l’âge, le sexe et l’indice de masse corporelle, deux doses de vaccin semblent réduire de moitié le risque de développer des symptômes de longue durée (OR 0.51, IC95% (0,32–0,82).
- Une autre étude cas-témoins a comparé 33 940 patients atteint de COVID-19 vaccinés préalablement et 113,474 patients infectés non vaccinés de janvier à octobre 2021. Les personnes vaccinées infectées par le COVID-19 présentent un risque plus faible de décès (HR = 0,66, IC95% (0,58 – 0,74)) et un risque légèrement plus faible de séquelles post-aiguës (HR = 0,85 IC95% (0,82 - 0,89)) par rapport aux patients atteints de COVID-19 non vaccinés. Le risque de développer des séquelles pulmonaires est diminué de moitié chez les patients vaccinés (HR = 0,51 IC95% (0,46 – 0,57)) [4].
- Une autre étude épidémiologique par essai émulé suggère que la vaccination de patients présentant des symptômes de COVID long permettrait de diminuer l’intensité des symptômes et l’impact sur leur qualité de vie [6]. Cette étude a inclus des patients présentant des symptômes de COVID persistant au-delà de 3 semaines. Les patients ayant bénéficié d’une vaccination COVID dans les 60 premiers jours de suivi présentent une réduction significative des symptômes, avec 16,6% des patients ne présentant plus de symptômes après 120 jours de suivi, contre 7,5% parmi les patients n’ayant pas été vacciné dans les 60 premiers jours.
- Une méta-analyse de décembre 2022 [7] portant sur 860 783 patients met en évidence une protection par la vaccination de 43% sur la survenue de COVID long.
- Une étude observationnelle a évalué l'efficacité de la vaccination COVID-19 pour prévenir la survenue de l’affection post-COVID. Cette étude épidémiologique de cohorte a été menée sur des données de registres suédois. La cohorte comprenait tous les adultes (≥18 ans) ayant contracté la COVID-19 entre le 27 décembre 2020 et le 9 février 2022 dans deux provinces de Suède. Parmi les 299 692 individus vaccinés contre la COVID-19, 0,4 % ont été diagnostiqués avec un COVID long, comparé à 1,4 % des 290 030 non vaccinés (HRa = 0.42 IC95% (0.38 – 0.46)). De plus, l'efficacité variait entre 21 % pour une dose, 59 % pour deux doses et 73 % pour trois doses ou plus [8].
 Ces données suggèrent que la vaccination semble avoir un intérêt dans la prévention de l’affection post-COVID et pourrait avoir un intérêt dans sa prise en charge après l’apparition des symptômes.
Ces données suggèrent que la vaccination semble avoir un intérêt dans la prévention de l’affection post-COVID et pourrait avoir un intérêt dans sa prise en charge après l’apparition des symptômes.
Références
- Maladie à coronavirus (COVID-19) : affection post-COVID-19 https://www.who.int/fr/news-room/questions-and-answers/item/coronavirus-disease-(covid-19)-post-covid-19-condition
- Whittaker HR, Gulea C, Koteci A, Kallis C, Morgan AD, Iwundu C, et al. GP consultation rates for sequelae after acute covid-19 in patients managed in the community or hospital in the UK: population based study. BMJ. 29 déc 2021;375:e065834. https://doi.org/10.1136/bmj-2021-065834
- Antonelli M, Penfold RS, Merino J, Sudre CH, Molteni E, Berry S, et al. Risk factors and disease profile of post-vaccination SARS-CoV-2 infection in UK users of the COVID Symptom Study app: a prospective, community-based, nested, case-control study. Lancet Infect Dis. janv 2022;22(1):43‑55. https://doi.org/10.1016/S1473-3099(21)00460-6
- Al-Aly Z, Bowe B, Xie Y. Long COVID after breakthrough SARS-CoV-2 infection. Nat Med. 25 mai 2022;1‑7. https://doi.org/10.1038/s41591-022-01840-0
- Azzolini E, Levi R, Sarti R et al. Association Between BNT162b2 Vaccination and Long COVID After Infections Not Requiring Hospitalization in Health Care Workers. JAMA July 1, 2022. https://doi.org/10.1001/jama.2022.11691
- Tran V, Perrodeau E, Saldanha J, et al, Efficacy of first dose of covid-19 vaccine versus no vaccination on symptoms of patients with long covid: target trial emulation based on ComPaRe e-cohort, BMJ Medicine 2023;2:e000229. doi: https://doi.org/10.1136/bmjmed-2022-000229
- Tsampasian V, Elghazaly H, Chattopadhyay R, Debski M, Naing TKP, Garg P, et al. Risk Factors Associated With Post−COVID-19 Condition: A Systematic Review and Meta-analysis. JAMA Intern Med. 2023; https://doi.org/10.1001/jamainternmed.2023.0750
- Lundberg-Morris L, Leach S, Xu Y, Martikainen J, Santosa A, Gisslén M, et al. Covid-19 vaccine effectiveness against post-covid-19 condition among 589 722 individuals in Sweden: population based cohort study. BMJ. 22 nov 2023;383:e076990. https://doi.org/10.1136/bmj-2023-076990
Concernant la grossesse :
|
Risque accru de covid grave pendant la grossesse
Plusieurs études révèlent que les femmes enceintes présentent un risque plus élevé de développer une forme grave de COVID-19 [3-6] avec un sur-risque de décès (risque relatif RR = 1,7) [3]. Les femmes enceintes présentant des comorbidités (surpoids, hypertension, diabète etc.) semblent présenter un risque accru de développer des formes sévères de la COVID-19, notamment au cours du 3ème trimestre de grossesse. La COVID-19 pendant la grossesse est également associé à un risque accru de complications spécifiques à la grossesse : pré-éclampsie, naissance prématurée et mortalité périnatale [6-10].
Efficacité et sécurité du vaccin ARNm pendant la grossesse
![]() Il a été montré que le vaccin par ARN est aussi efficace pour les femmes enceintes que pour la population générale [11].
Il a été montré que le vaccin par ARN est aussi efficace pour les femmes enceintes que pour la population générale [11].
![]() Les études chez l’animal n’ont pas mis en évidence d’effets délétères sur la gestation [12], le développement embryonnaire et fœtal. Chez la femme enceinte, une étude prospective publiée dans le NEJM parmi une cohorte de femmes entre 16 et 54 ans, vaccinées et enceintes ou enceintes après la vaccination par un vaccin à ARNm (Pfizer-BioNtech ou Moderna) n’a pas montré d’augmentation des effets indésirables locaux et systémiques dans cette population par rapport à la population générale. Dans une deuxième cohorte de 3958 femmes enceintes au moment de la vaccination par un vaccin à ARNm (Pfizer-BioNtech ou Moderna) l’étude ne retrouve pas d’augmentation des complications de la grossesse (avortement spontané, naissance prématurée etc.) par rapport à ceux attendus dans cette population [12]. Une étude canadienne publiée en aout 2022 sur près de 43000 femmes enceintes vaccinées par ARNm conclu à la même absence de sur risque. [13]
Les études chez l’animal n’ont pas mis en évidence d’effets délétères sur la gestation [12], le développement embryonnaire et fœtal. Chez la femme enceinte, une étude prospective publiée dans le NEJM parmi une cohorte de femmes entre 16 et 54 ans, vaccinées et enceintes ou enceintes après la vaccination par un vaccin à ARNm (Pfizer-BioNtech ou Moderna) n’a pas montré d’augmentation des effets indésirables locaux et systémiques dans cette population par rapport à la population générale. Dans une deuxième cohorte de 3958 femmes enceintes au moment de la vaccination par un vaccin à ARNm (Pfizer-BioNtech ou Moderna) l’étude ne retrouve pas d’augmentation des complications de la grossesse (avortement spontané, naissance prématurée etc.) par rapport à ceux attendus dans cette population [12]. Une étude canadienne publiée en aout 2022 sur près de 43000 femmes enceintes vaccinées par ARNm conclu à la même absence de sur risque. [13]
Ainsi, en France, la vaccination avec une deuxième dose de rappel (aussi appelée ‘‘quatrième dose’’) est recommandée pour les femmes enceintes. Quel que soit le terme de la grossesse.[1 et 2] Avec un espacement des doses de 6 mois.
Malgré ces données, une étude récente rapporte que la couverture vaccinale était nettement plus faible chez les femmes enceintes : 32 % des femmes ayant accouché en octobre 2021 avaient reçu deux doses de vaccin, contre 77 % pour l'ensemble des femmes [10].
Vaccination pendant l’allaitement :
|
Une étude réalisée à Singapour à montrer de très faible quantité d’ARNm, sans possibilité de différencier les résidus des ARNm fonctionnels, chez 4 des 35 femmes participantes (en moyenne 0.02% de la dose injectée). Aucun des enfants testés ne présentait d’ARNm dans le sang, probablement grâce à une dégradation dans le système digestif. [17]
En revanche, des anticorps de type A et IgG spécifiques anti SARS-CoV2 sont sécrétés dans le lait après la vaccination [18]. Par analogie avec d’autres maladies infectieuses (comme la coqueluche [19] ou la grippe), il est possible que les anticorps transmis à l’enfant par le lait lui expliquent cette protection observée chez les nouveaux nés de femmes vaccinées.
Au vu de ces éléments, la HAS stipule désormais (en compléments des recommandations de février 2021) que la vaccination par un vaccin à ARNm est envisageable chez une femme qui allaite.
Protection des nouveaux nés
Une étude norvégienne parue en juin 2022 [14], réalisée chez la population générale en période de prédominance des variants Delta puis Omicron, chez plus de 21000 enfants durant les 4 premiers mois de leur vie, montre un taux de contamination par le coronavirus (PCR positive) inférieur chez les nouveaux nés de mère vaccinée par vaccin à ARNm : Lors de la période de prédominance du variant Delta, le nombre d’infection était inférieur de 64% dans le groupe des nouveau nés de mères vaccinées (1.2 vs 3 cas par 10 000 jours de suivi) et inferieur de 27% lors de la période de prédominance du variant Omicron (7 vs 10.9 cas par 10 000 jours de suivi). Le nombre de doses de vaccins semblait corrélé à une plus grande diminution de la contamination. Ce résultat est important puisqu’il suggère un effet protecteur passif du nouveau-né par la vaccination maternelle, alors que ces enfants présentent des infections plus sévères que les enfants plus âgés et qu’il n’existe pas encore de vaccin pour les moins de 5 ans. Une autre étude américaine [15] parue en juillet 2022, confirme ces données et les précise en montrant une diminution du nombre et de la gravité des infections covid (moins de recours aux soins intensifs) chez les nouveaux nés de mères vaccinées avec deux doses. La protection semble maximale lorsque la deuxième injection est réalisée le troisième trimestre. La transmission d’anticorps par le sang du cordon et le lait maternel ainsi que la baisse de transmission du coronavirus par les mères vaccinées, peuvent expliquer ce résultat. Cette étude ne mettait pas en évidence plus d’effets indésirables chez les femmes vaccinées.
Une étude canadienne parue en février 2023 [20] réalisée dans la population générale en période de prédominance des variants Delta puis Omicron, chez plus de 13000 enfants durant les 6 premiers mois de leur vie montre que les nourrissons des femmes qui ont reçu deux doses de vaccin mRNA dont une des deux doses a été réalisée pendant sa grossesse, bénéficient d'un effet protecteur du vaccin de 95% (IC95% 88-98%) contre l’infection du variant Delta et de 45% (IC95% 37 à 53%) contre l’infection du variant Omicron. Cette efficacité est augmentée jusqu’à 73% (IC95% 61-80%) contre l’infection du variant Omicron si la mère a reçu une 3ème dose de vaccin mRNA pendant leur grossesse. Cette étude montre aussi que la protection est plus élevée lorsque la deuxième dose est réalisée au troisième trimestre (53%(IC95% 42-62%)) par rapport au première (47%(IC95 31-59%) ou deuxième (37%(IC95% 24-47%) trimestre. Ces résultats sont cohérents avec ceux de l'étude américaine citée au-dessus. En revanche, l’efficacité de 2 doses du vaccin contre l’infection du variant Omicron chez les nouveau-nés a diminué de 57% (IC95% 44 à 66%) entre la naissance et 8 semaines à 40% (IC95% 21 à 54%) après l’âge de 16 semaines. Ainsi, deux doses de vaccin mRNA chez la mère pendant la grossesse permettent réduire le risque d’hospitalisation des nouveau-nés due à cette infection; l’efficacité est de 97% (IC95% 73-100%) contre le variant Delta et de 53% (IC95% 39-64%) contre le variant Omicron. L’effet protecteur est de 80% (IC95% 64-89%) contre le variant Omicron si la mère a reçu une troisième dose du vaccin pendant sa grossesse.
Une étude publiée dans le JAMA en septembre 2023 [21] décrit l’apparition d’infection par les variants Omicron, dont le variant XBB, chez 7292 enfants de moins de 7 mois. Il est rapporté trois modalités de couverture vaccinale de la mère. La première est l’absence de vaccination, la seconde est la réalisation d’un schéma vaccinal avant la grossesse, et la troisième est l’injection d’une dose booster (2nd ou 3ème dose) pendant la grossesse. L’étude rapporte une efficacité de 41,5% (IC 95%, 22,8%-55,7%) contre l’infection à Omicron pour le seul groupe dont la mère a reçu au moins une dose booster pendant la naissance, et l’absence d’effet protecteur chez l’enfant d’un schéma vaccinal réalisé avant la grossesse par rapport aux femmes n’ayant pas été vaccinées. L’étude suggère également une protection contre le variant XBB mais uniquement chez les femmes ayant bénéficié d’une 3ème dose pendant la grossesse.
|
Références :
1. La stratégie vaccinale et la liste des publics prioritaires. Ministère des Solidarités et de la Santé. 2022 https://solidarites-sante.gouv.fr/grands-dossiers/vaccin-covid-19/publics-prioritaires-vaccin-covid-19
2. https://www.has-sante.fr/jcms/p_3352553/fr/covid-19-une-dose-de-rappel-vaccinal-additionnelle-ouverte-a-davantage-de-personnes-et-des-delais-precises
3. Zambrano LD, Ellington S, Strid P, Galang RR, Oduyebo T, Tong VT, et al. Update: Characteristics of Symptomatic Women of Reproductive Age with Laboratory-Confirmed SARS-CoV-2 Infection by Pregnancy Status - United States, January 22-October 3, 2020. MMWR Morb Mortal Wkly Rep. 6 nov 2020;69(44):1641‑7.
4. Pregnancy and risk of COVID‐19: a Norwegian registry‐linkage study - Magnus - 2022 - BJOG: An International Journal of Obstetrics & Gynaecology - Wiley Online Library [Internet]. [cité 17 janv 2022]. Disponible sur: https://obgyn.onlinelibrary.wiley.com/doi/10.1111/1471-0528.16969
5. Ellington S, Strid P, Tong VT, Woodworth K, Galang RR, Zambrano LD, et al. Characteristics of Women of Reproductive Age with Laboratory-Confirmed SARS-CoV-2 Infection by Pregnancy Status - United States, January 22-June 7, 2020. MMWR Morb Mortal Wkly Rep. 26 juin 2020;69(25):769‑75.
6. Allotey J, Stallings E, Bonet M, Yap M, Chatterjee S, Kew T, et al. Clinical manifestations, risk factors, and maternal and perinatal outcomes of coronavirus disease 2019 in pregnancy: living systematic review and meta-analysis. BMJ. 1 sept 2020;370:m3320.
7. Villar J, Ariff S, Gunier RB, Thiruvengadam R, Rauch S, Kholin A, et al. Maternal and Neonatal Morbidity and Mortality Among Pregnant Women With and Without COVID-19 Infection: The INTERCOVID Multinational Cohort Study. JAMA Pediatrics. 1 août 2021;175(8):817‑26.
8. Papageorghiou AT, Deruelle P, Gunier RB, Rauch S, García-May PK, Mhatre M, et al. Preeclampsia and COVID-19: results from the INTERCOVID prospective longitudinal study. Am J Obstet Gynecol. sept 2021;225(3):289.e1-289.e17.
9. Wei SQ, Bilodeau-Bertrand M, Liu S, Auger N. The impact of COVID-19 on pregnancy outcomes: a systematic review and meta-analysis. CMAJ. 19 avr 2021;193(16):E540‑8.
10. Stock SJ, Carruthers J, Calvert C, Denny C, Donaghy J, Goulding A, et al. SARS-CoV-2 infection and COVID-19 vaccination rates in pregnant women in Scotland. Nat Med. 13 janv 2022;1‑9.
11. Dagan N, Barda N, Biron-Shental T, Makov-Assif M, Key C, Kohane IS, et al. Effectiveness of the BNT162b2 mRNA COVID-19 vaccine in pregnancy. Nat Med. oct 2021;27(10):1693‑5.
12. https://www.ema.europa.eu/en/documents/rmp-summary/comirnaty-epar-risk-management-plan_en.pdf (page 36)
13. Preliminary Findings of mRNA Covid-19 Vaccine Safety in Pregnant Persons | NEJM https://www.nejm.org/doi/full/10.1056/nejmoa2104983
14. Fell DB, Dimanlig-Cruz S, Regan AK, Håberg SE, Gravel CA, Oakley L, et al. Risk of preterm birth, small for gestational age at birth, and stillbirth after covid-19 vaccination during pregnancy: population based retrospective cohort study. BMJ [Internet]. 2022 Aug 17 [cited 2022 Aug 22];378:e071416. Available from: https://www.bmj.com/content/378/bmj-2022-071416
15. Carlsen EØ, Magnus MC, Oakley L, Fell DB, Greve-Isdahl M, Kinge JM, et al. Association of COVID-19 Vaccination During Pregnancy With Incidence of SARS -CoV-2 Infection in Infants. JAMA Internal Medicine. 2022 Jun 1 [cited 2022 Jun 7]; Available from: https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2793109
16 Halasa NB, Olson SM, Staat MA, Newhams MM, Price AM, Pannaraj PS, et al. Maternal Vaccination and Risk of Hospitalization for Covid-19 among Infants. New England Journal of Medicine. 2022 Jun 22;
17. Yeo KT, Chia WN, Tan CW, et al. Neutralizing activity and SARS-CoV-2 vaccine mRNA persistence in serum and breastmilk after BNT162b2 vaccination in lactating women. Front Immunol. 2022;12:783975 .
18. Perl SH, Uzan-Yulzari A, Klainer H, et al. SARS-CoV-2-specific antibodies in breast milk after COVID-19 vaccination of breastfeeding women. JAMA 2021;325: 2013-4
19. Carcione D, Regan AK, Tracey L, et al. The impact of parental postpartum pertussis vaccination on infection in infants: a population-based study of cocooning in Western Australia. Vaccine. 2015;33(42):5654-5661. doi:10.1016/j.vaccine.2015.08.066 20.
20. Sarah J, Jeffrey CK and al. Maternal mRNA covid-19 vaccination during pregnancy and delta or omicron infection or hospital admission in infants: test negative design study. BMJ 2023; 380 doi: https://doi.org/10.1136/bmj-2022-074035
21. Goh O, Pang D, Tan J, et al. mRNA SARS-CoV-2 Vaccination Before vs During Pregnancy and Omicron Infection Among Infants. JAMA Netw Open. 2023;6(11):e2342475. https://doi.org/10.1001/jamanetworkopen.2023.42475
Le SARS-Cov2 se transmet principalement entre personnes physiquement proches, soit par microgouttelettes aéroportées, soit par diffusion de particules en suspension dans un milieu peu ventilé. Pour entraîner une infection, ces gouttelettes ou particules, provenant des voies aériennes et contenant le virus, doivent pénétrer les muqueuses en nombre suffisant au niveau des yeux, du nez ou de la bouche. Il existe également une transmission par contacte avec une surface portant le virus (le plus souvent par l’intermédiaire des mains), ce dernier mode de transmission reste peu représenté grâce au temps faible de survie du virus hors du corps, il est d’ailleurs facilement prévenu par le lavage des mains et l’application de gel hydroalcoolique.
Les données précliniques chez des singes exposés au vaccin Moderna (MRNO-1273), ont montré qu’après inoculation du virus par voie nasale, l’élimination virale des voies aériennes est rapide en moins de 2 jours et suggèrent un effet de la vaccination sur la réduction de la transmission chez l’homme. [1]
La vaccination des parents (Vaccin Pfizer /BNT162b2) réduit le risque d’infection des enfants non vaccinés vivant au foyer lors de la circulation du variant alpha 71.7% pour le variant alpha et 58.1% pour le variant delta. Bien qu’il soit toujours difficile d’éviter les biais dans ce type d’étude, les résultats sont nettement en faveur d’une réduction de la transmission grâce à la vaccination, ce d’autant que les possibilités de transmission en dehors des parents sont nombreuses, notamment à l’école ou par la fratrie. [2]
Plusieurs autres études aboutissent aux mêmes conclusions. Une étude écossaise faite entre décembre 2020 et Mars 2021 a montré une diminution de 68% de la transmission du virus aux membres du foyer d’un professionnel de santé ayant reçu 2 doses de vaccin Pfizer (BNT162b2) ou AstraZeneca (ChAdOx1 nCov-19) [3]. Ou une étude anglaise portant sur les risques d’infection de personnes non vaccinées vivant avec des personnes infectées mais ayant reçu au moins une dose de vaccin Pfizer (BNT162b2) ou AstraZeneca (ChAdOx1 nCov-19) entre Janvier et février 2021. Les résultats montrent une diminution du risque relatif d’infection de 40 à 50% à partir de 2 semaines suivant la vaccination, quel que soit le vaccin [4]
Enfin, un article paru en février 2022 a montré la réduction conjointe de la transmission et de la réduction de la charge virale en fonction du statut vaccinal des adultes infectées et de leurs contacts. La diminution du risque relatif d’infection par un patient vacciné par deux doses de BNT162b1 (Vaccin Pfizer) de 68% par le variant Alpha et 50% par le variant Delta. A ces résultats s’ajoutent un net effet de la vaccination sur la charge virale, même s’il est moindre chez les patients infectés par le variant Delta, mais cela n’explique que partiellement la diminution de la transmission. La réduction de la transmission est maximale lors que les cas et les contacts sont tous les deux vaccinés par 2 doses, avec une réduction du risque relatif d’infection chez les patients vaccinés par le vaccin Pfizer de 85% pour le variant Alpha et de 81% pour le variant Delta. (60% et 58% respectivement avec 2 doses du vaccin AstraZeneca), cependant cet effet s’atténue avec le temps ce qui justifie la dose de rappel [5]. En période omicron, la vaccination, l'infection antérieure seule et la vaccination et l'infection antérieure réduisent le risque de transmission de l'infection d'un cas index de 22 % (6-36 %), 23 % (3-39 %) et 40 % (20-55 %), respectivement dans un milieu carcéral [6]. L’effet de réduction de transmission est plus important si la dose de rappel est récente.
 Ces résultats nous permettent de retenir un effet incontestable de la vaccination à jour sur la transmission du SARS-Cov2 et de proposer des stratégies de cocooning pour protéger les plus fragiles non éligibles (nourrissons) ou chez qui la vaccination est moins efficace (immunodéprimés…)
Ces résultats nous permettent de retenir un effet incontestable de la vaccination à jour sur la transmission du SARS-Cov2 et de proposer des stratégies de cocooning pour protéger les plus fragiles non éligibles (nourrissons) ou chez qui la vaccination est moins efficace (immunodéprimés…)
Références
- Corbett KS, Flynn B, Foulds KE, Francica JR, Boyoglu-Barnum S, Werner AP, et al. Evaluation of the mRNA-1273 Vaccine against SARS-CoV-2 in Nonhuman Primates. New England Journal of Medicine. 2020 Jul 28; https://www.nejm.org/doi/full/10.1056/NEJMoa2024671
- Hayek S, Shaham G, Ben-Shlomo Y, Kepten E, Dagan N, Nevo D, et al. Indirect protection of children from SARS-CoV-2 infection through parental vaccination. Science. 2022 Jan 27; https://www.science.org/doi/10.1126/science.abm3087
- Shah ASV, Gribben C, Bishop J, Hanlon P, Caldwell D, Wood R, et al. Effect of Vaccination on Transmission of SARS-CoV-2. New England Journal of Medicine. 2021 Oct 28;385(18):1718–20. https://www.nejm.org/doi/full/10.1056/NEJMc2106757
- Harris RJ, Hall JA, Zaidi A, Andrews NJ, Dunbar JK, Dabrera G. Effect of Vaccination on Household Transmission of SARS-CoV-2 in England. New England Journal of Medicine. 2021 Jun 23; https://www.nejm.org/doi/full/10.1056/NEJMc2107717
- Eyre DW, Taylor D, Purver M, Chapman D, Fowler T, Pouwels KB, et al. Effect of Covid-19 Vaccination on Transmission of Alpha and Delta Variants. New England Journal of Medicine. 2022 Jan 5; https://www.nejm.org/doi/full/10.1056/NEJMoa2116597
- Tan ST, Kwan AT, Rodríguez-Barraquer I, Singer BJ, Park HJ, Lewnard JA, et al. Infectiousness of SARS-CoV-2 breakthrough infections and reinfections during the Omicron wave. Nature med Jan 23 https://www.nature.com/articles/s41591-022-02138-x
La réponse à cette question est issue d’un consensus d’experts.
Comme pour toute prise de médicament, la vaccination peut entraîner la survenue d'effets indésirables. Quel que soit le vaccin, l’effet indésirable le plus fréquemment rencontré est la douleur au point d’injection, liée à l’administration intramusculaire du vaccin. On retrouve également fréquemment ce qu’on appelle un syndrome pseudo-grippal : fièvre, fatigue, maux de tête, douleurs musculaires. Ce syndrome peut durer quelques jours.
Concernant les vaccins actuellement disponibles, les données actuelles sont rassurantes :
Concernant les vaccins à ARNm (vaccin COMIRNATY BioNTech – Pfizer et COVID-19 VACCINE Moderna) :
Une étude récente a montré que les effets indésirables après l’administration d’une troisième dose d’un vaccin ARNm administrée 5 à 8 mois après la fin d’une série de 2 doses de primovaccination par le même vaccin ARNm étaient similaires à ceux signalés après la réception de la deuxième dose [9]. Une étude israélienne récente suggère un risque plus faible de myocardite après la troisième dose. [10] |
Références :
- Polack FD, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. New England J Med (31/12/2020) https://doi.org/10.1056/NEJMoa2034577
- Baden, LR, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. New England J Med (30/12/2020) https://doi.org/10.1056/NEJMoa2035389
- https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-01/06-COVID-Shimabukuro.pdf
- https://www.gov.uk/government/publications/coronavirus-covid-19-vaccine-adverse-reactions/coronavirus-vaccine-summary-of-yellow-card-reporting
- https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-06/03-COVID-Shimabukuro-508.pdf
- Communiqué de la Société Française de Médecine Vasculaire (SFMV) et du Groupe Français d’Etudes sur l’Hémostase et la Thrombose (GFHT) https://www.portailvasculaire.fr/sites/default/files/actualites/fichiers/questions_autour_de_la_vaccination_contre_la_covid_sfmv_gfht.pdf
- Barda N et al., Safety of the BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Setting. N Engl J Med 2021; 385:1078-1090 DOI: 10.1056/NEJMoa2110475
- Iwanaga J, Fukuoka H, Fukuoka N, Yutori H, Ibaragi S, Tubbs RS. A narrative review and clinical anatomy of herpes zoster infection following COVID ‐19 vaccination. Clinical Anatomy. 2021 Oct; https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8652627/
- Hause AM, Baggs J, Gee J, Marquez P, Myers TR, Shimabukuro TT, et al. Safety Monitoring of an Additional Dose of COVID-19 Vaccine — United States, August 12–September 19, 2021. MMWR Morb Mortal Wkly Rep. 1 oct 2021;70(39):1379‑84.
- Friedensohn L, Levin D, Fadlon-Derai M, Gershovitz L, Fink N, Glassberg E, et al. Myocarditis Following a Third BNT162b2 Vaccination Dose in Military Recruits in Israel. JAMA [Internet]. 2022 Mar 17 [cited 2022 Mar 18]; Available from: https://jamanetwork.com/journals/jama/fullarticle/2790421
- https://sfpt-fr.org/images/covid19/Communiqu%C3%A9_de_presse_de_la_Soci%C3%A9t%C3%A9_Fran%C3%A7aise_de_Pharmacologie_et_de_Th%C3%A9rapeutique_du_19_mars_2021.pdf
- Simpson CR, et al. First-dose ChAdOx1 and BNT162b2 COVID-19 vaccines and thrombocytopenic, thromboembolic and hemorrhagic events in Scotland. Nat Med. 2021 Jun 9. https://doi.org/10.1038/s41591-021-01408-4
- TTS with Janssen's COVID-19 vaccine. Reactions Weekly. 2021;1855(1):12. doi:10.1007/s40278-021-95688-3
- https://www.ema.europa.eu/en/documents/chmp-annex/annex-vaxzevria-art53-visual-risk-contextualisation_en.pdf
- EMA. Meeting highlights from the Pharmacovigilance Risk Assessment Committee (PRAC) 24 - 27 October 2022 [Internet]. Eur. Med. Agency. 2022 [cited 2023 Jan 2]. Available from: https://www.ema.europa.eu/en/news/meeting-highlights-pharmacovigilance-risk-assessment-committee-prac-24-27-october-2022
- Edelman A, Boniface ER, Male V, et al Association between menstrual cycle length and covid-19 vaccination: global, retrospective cohort study of prospectively collected data BMJ Medicine 2022;1:e000297. doi: 10.1136/bmjmed-2022-000297
La réponse à cette question est issue d’un consensus d'experts.
![]() Non, les vaccins injectés par voie intramusculaire n'éviteront que partiellement l’infection. Ils limiteront la réplication du virus et la progression vers des formes sévères de la Covid-19. C’est déjà le cas avec le vaccin de la grippe saisonnière qui diminue seulement de 50% l’infection mais protège des formes graves. Pour la Covid-19, la diminution des formes graves et de la réplication virale va diminuer la contagiosité [1,2].
Non, les vaccins injectés par voie intramusculaire n'éviteront que partiellement l’infection. Ils limiteront la réplication du virus et la progression vers des formes sévères de la Covid-19. C’est déjà le cas avec le vaccin de la grippe saisonnière qui diminue seulement de 50% l’infection mais protège des formes graves. Pour la Covid-19, la diminution des formes graves et de la réplication virale va diminuer la contagiosité [1,2].
L’efficacité d’un vaccin peut-être évaluée par les études cliniques qui comparent le risque relatif de développer la maladie entre une population vaccinée et une population non vaccinée et les études sérologiques reflétant la protection clinique de manière indirecte par la séroconversion après vaccination (deux à six semaines plus tard). A l’heure actuelle il n’existe pas de vaccin connu dont l’efficacité induit une protection à 100%.
 Voir la question 20 pour les données d’efficacité sur les variants du virus
Voir la question 20 pour les données d’efficacité sur les variants du virus
Références :
- Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3
- Flanagan KL, Best E, Crawford NW, Giles M, Koirala A, Macartney K, Russell F, Teh BW and Wen SCH (2020) Progress and Pitfalls in the Quest for Effective SARS-CoV-2 (COVID-19) Vaccines. Immunol. 11:579250. https://doi.org/10.3389/fimmu.2020.579250
Tous les vaccins mis sur le marché sont administrés par voie intramusculaire. Les rares vaccins développés pour être administrés par voie intranasale ou sublinguale, qui présentent l’avantage de créer une immunité des voies aériennes, sont peu avancés en développement.
Au 10 mai 2022, selon les données de l'OMS (1) on recense plus de 300 vaccins candidats en cours de développement dont 155 sont en phase d’évaluation chez l’homme, parmi lesquels 51 sont en phase III, c’est-à-dire au stade de l’évaluation de leur efficacité chez l’homme avant leur mise sur le marché (AMM). Douze vaccins sont commercialisés dans le monde, tous ne sont pas autorisés en France.
En France, à ce jour, sont autorisés deux vaccins à ARN, deux vaccins à vecteur viral non répliquant, et 1 vaccin protéique (voir la Q/R06 pour la définition) :
-
Vaccins à ARNm :
- le vaccin Comirnaty® ou BNT162b2 (laboratoire BioNTech – Pfizer) (2), titulaire d'une AMM et qui fait l'objet du démarrage (le 27/12/2020) de la campagne de vaccination en France,
- le Spikevax® ou mRNA-1273 (laboratoire Moderna) (3), a obtenu une AMM de la part de l'Agence Européenne du Médicament (EMA) le 06/01/2021, et a été incluse dans la stratégie vaccinale en France par la HAS le 8 Janvier. L'efficacité initiale rapportée dans ces études était de 95% et de 94,1% avec le BNT162b2 et le mRNA-1273, respectivement. -
Vaccins à vecteur viral :
- Le vaccin Vaxzevria® ou ChAdOx1 (anciennement Vaccin AstraZeneca COVID-19), constitué d’un vecteur viral non répliquant adenovirus (laboratoire AstraZeneca et université d’Oxford), est titulaire d’une AMM de la part de l'Agence Européenne du Médicament depuis le 29 Janvier 2021. Son efficacité rapportée est de 62,17% (4)
- Le vaccin Jcovden® ou Ad26.COV2-S (anciennement Vaccin Janssen COVID-19), est un vaccin à à adenovirus (laboratoire Janssen). Il a reçu une AMM conditionnelle le 11 mars 2021 . Sonefficacité rapportée est de 66,1 à 66,9%. (5) -
Vaccin protéique :
Le vaccin Nuvaxovid® ou NVX-CoV2373 (laboratoire Novavax) constitué d’une protéine Spike recombinante et d’un adjuvant protéique, dispose d’une AMM européenne depuis le 20 décembre 2022. Son efficacité rapportée est de 90%.
Les chiffres d’efficacité rapportés ici sont ceux présentés sur le site de l’agence européenne du médicament et concernent la réduction des infections symptomatiques. Ce chiffre est susceptible de varier en vie réelle et en fonction des variants (voir la question 20 pour les données d’efficacité sur les variants).
Les effets indésirables rapportés étaient ceux classiquement observés avec les vaccins (douleur au point d'injection, fatigue, maux de tête, douleurs musculaires) (voir la question 11 pour plus d’informations, , notamment concernant les effets indésirables rares).
 Pour suivre l’actualité des vaccins candidats et leurs étapes de développement, l’OMS met à jour une base de données deux fois par semaine et est ouverte à tous : https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines. Vous pouvez aussi consulter la page de l'European Medicines Agency sur les dernières mises à jours sur les vaccins développés et en développement
Pour suivre l’actualité des vaccins candidats et leurs étapes de développement, l’OMS met à jour une base de données deux fois par semaine et est ouverte à tous : https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines. Vous pouvez aussi consulter la page de l'European Medicines Agency sur les dernières mises à jours sur les vaccins développés et en développement
Références
- World Health organisation. COVID-19 vaccine tracker and landscape. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines
- Polack FD, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. New England J Med (31/12/2020) https://doi.org/10.1056/NEJMoa2034577
- Baden, LR, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. New England J Med (30/12/2020) https://doi.org/10.1056/NEJMoa2035389
- https://www.has-sante.fr/jcms/p_3235868/fr/strategie-de-vaccination-contre-la-covid-19-place-du-covid-19-vaccine-astrazeneca-dans-la-strategie
- https://www.has-sante.fr/jcms/p_3242795/fr/strategie-de-vaccination-contre-la-covid-19-place-du-vaccin-covid-19-janssen
-
European Medicines Agency : dernières mises à jours sur les vaccins développés et en développement https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/covid-19-vaccines
La réponse à cette question a fait l'objet d'un consensus d'experts.
Les mutations sont des modifications du génome viral. La majorité des mutations sont létales (incapacité de reproduction) ou silencieuses (ne modifiant pas les propriétés ou les fonctions de la protéine codée par cette séquence génomique). Toutefois certaines mutations vont engendrer de nouvelles propriétés, qui seront soumises à la pression de sélection.
Le SARS-CoV-2 est un virus à ARN dont le génome est organisé de la même façon que les autres beta-coronavirus. Ses 6 domaines principaux codent pour une replicase, la protéine spike, la protéine d’enveloppe, la protéine de membrane, et la nucléocapside. Le SARS-CoV-2 partage 90% de ce code avec le SARS-CoV, sauf pour la protéine spike qui est différente [1]. Cependant, le SARS-CoV-2 mute constamment, des dizaines de milliers de mutations étaient décrites, la plupart n’ayant pas de conséquence fonctionnelle [2].
Les mutations identifiées qui posent des problèmes actuellement sont celles du domaine de liaison au récepteur (receptor binding domain RBD en anglais) et sur le domaine N-terminal (NTD), se trouvant tous deux au sein de la protéine S (spike), qui est la cible des anticorps neutralisants. Le terme variant est utilisé pour définir un sous-type du virus retrouvé à plusieurs reprises et comportant les mêmes mutations. A l’heure actuelle, une vigilance est portée sur les variants suivants appelés « variants of concern » [3] car ils présentent des caractéristiques différentes en termes de transmission et/ou virulence et /ou pathogénicité : le « variant alpha, (B.1.1.7), le « variant bêta, (B.1.351), le « variant gamma (B.1.1.28), le « variant delta, (B.1.617) et le « variant omicron » (B.1.1.529).
VARIANTS ALPHA ET BETA
Dans les études initiales de phase 3 des vaccins à ARNm, les efficacités retrouvées sur la Covid symptomatique étaient de 95 % pour le Comirnaty® [4] et 94,1 % pour le vaccin de Moderna [5]. Dès mars 2021, dans une étude réalisée au Qatar [6], on observait une baisse de l’effectivité du vaccin Pfizer/Biotech-Comirnaty® pour la Covid non grave, celle-ci étant de 89.5% sur le variant alpha et de 75% sur le variant bêta. Par contre, l’effectivité de ce vaccin sur les formes graves pour les deux variants restait excellente, supérieure à 95 %.
VARIANT DELTA
De façon similaire, l’effectivité vis-à-vis du variant delta, après la seconde injection de vaccin Pfizer/Biotech-Comirnaty®, diminue à 51.9% pour la Covid symptomatique. Comparativement, le vaccin de Moderna conserve une effectivité autour de 73% pour la Covid symptomatique après deux injections. Néanmoins, il est intéressant de noter que ces deux vaccins restent très puissants pour prévenir les formes sévères avec respectivement 93.4% et 96.1% d’efficacité pour le vaccin Pfizer/Biotech-Comirnaty® et le vaccin de Moderna [7]. Une troisième dose améliore nettement l’effectivité de la vaccination. L’ajout d’une 3ème dose de vaccin Pfizer/Biotech-Comirnaty® 5 mois après les deux doses initiales induit une efficacité de 93 % pour l'admission à l'hôpital, 92 % pour la Covid grave par rapport à la réception de deux doses seulement, et permet donc de corriger la perte d’efficacité vaccinale au cours du temps [8].
VARIANT OMICRON
Les données épidémiologiques fournies par l’enquête de la DREES [9] ont permis de mettre en avant une baisse de l’effectivité vaccinale contre le variant omicron par rapport au précédent variant majoritaire (delta), notamment après 2 doses de vaccins. Ainsi, en l’absence de rappel vaccinal, on constate une effectivité de 50% sur les hospitalisations (lorsqu’elle était de 85% contre le variant delta) et de 70% (contre 90% précédemment) sur les passages en soins critiques. A nouveau, la 3ème dose joue un rôle primordial puisqu’on remarque que cette différence est rattrapée avec une effectivité sur les hospitalisations et sur le passage en soins critiques qui remonte respectivement à 80 et 92%.
Effectivité de la 4ème dose de vaccin Comirnaty® lors de la vague Omicron : Une étude de cohorte menée en Israël chez une population très âgée, étudiant l’impact d’une 4ème dose de vaccin Comirnaty® lors de la vague Omicron, montre une protection élevée contre les hospitalisations et les décès liés à la COVID-19 [10] . Dans une étude menée en Suède, on retrouve des résultats similaires comparativement à une 3ème dose seule avec 71% d’effectivité pour les personnes de plus de 80 ans vivant au domicile et 39% pour celles vivant dans des établissements de soins longue durée [11]. Dans une étude sur base de données réalisée à Singapour, pendant une période comprenant Omicron BA.5, l’effectivité chez les plus de 80 ans du deuxième rappel par rapport à un seul rappel est de 22% sur les infections, 55% sur les hospitalisations et 63% sur les formes graves (recours à l’oxygène, passage en réanimation ou décès) [12].
Des vaccins combinés sont autorisées pour s’adapter aux variants (voir la question : 26-Qu’en est-il des vaccins ARNm bivalents ? Quel peut être leur intérêt dans la COVID-19?)
| |
Références
[1] Hu, B., Guo, H., Zhou, P. et al. Characteristics of SARS-CoV-2 and COVID-19. Nat Rev Microbiol 19, 141–154 (2021). https://doi.org/10.1038/s41579-020-00459-7
[2] Cell Host Microbe. 2021 Jan 29;S1931-3128(21)00045-7. doi: 10.1016/j.chom.2021.01.015. Online ahead of print.
[3] https://www.who.int/en/activities/tracking-SARS-CoV-2-variants/
[4] Polack FP, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020 Dec 31. https://doi.org/10.1056/NEJMoa2034577
[5] Baden LR, et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. February 4, 2021. NEJM. https://doi.org/10.1056/NEJMoa2035389
[6] Abu-Raddad LJ, Chemaitelly H, Butt AA. Effectiveness of the BNT162b2 Covid-19 Vaccine against the B.1.1.7 and B.1.351 Variants. New England Journal of Medicine https://www.nejm.org/doi/10.1056/NEJMc2104974
[7] Tang, P., Hasan, M.R., Chemaitelly, H. et al. BNT162b2 and mRNA-1273 COVID-19 vaccine effectiveness against the SARS-CoV-2 Delta variant in Qatar. Nat Med (2021). https://doi.org/10.1038/s41591-021-01583-4
[8] Barda N, Dagan N, Cohen C, Hernán MA, Lipsitch M, Kohane IS, Reis BY, Balicer RD. Effectiveness of a third dose of the BNT162b2 mRNA COVID-19 vaccine for preventing severe outcomes in Israel: an observational study. Lancet. 2021 Dec 4;398(10316):2093-2100. doi: 10.1016/S0140-6736(21)02249-2. Epub 2021 Oct 29.PMID: 34756184; PMCID: PMC8555967.
[9] DREES (Direction de la Recherche, des Études, de l’Évaluation et des Statistiques). La protection vaccinale demeure élevée contre les formes graves d’infection au variant Omicron, même si elle est inférieure à celle contre le variant Delta - https://drees.solidarites-sante.gouv.fr/sites/default/files/2022-01/2022-01-14%20-%20Appariements%20sivic-sidep-vacsi%20Drees%20-%20note%205.pdf
[10]. Muhsen K et al. Association of Receipt of the Fourth BNT162b2 Dose With Omicron Infection and COVID-19 Hospitalizations Among Residents of Long-term Care Facilities ; JAMA Internal Medicine, , June 23, 2022 ; https://doi.org:/10.1001/jamainternmed.2022.2658
[11] Effectiveness of a fourth dose of mRNA COVID-19 vaccine against all-cause mortality in long-term care facility residents and in the oldest old: A nationwide, retrospective cohort study in Sweden, The Lancet Regional Health - Europe 2022;00: 100466 https://doi.org/10.1016/j.lanepe.2022.100466.
[12] Tan CY et al. Effectiveness of a Fourth Dose of COVID-19 mRNA Vaccine Against Omicron Variant Among Elderly People in Singapore; Ann Intern Med, 2022 Sep 13. https://doi.org/10.7326/M22-2042
Les vaccins 'bivalents' font partie des initiatives développées pour répondre de façon plus adaptée à la situation de circulation majoritaire du variant Omicron et à la baisse de l’effectivité des vaccins de première génération qui en résulte. Ces vaccins contiennent en effet des ARNm codant pour une fraction de la protéine de la souche originelle Wuhan et pour l’un des sous variants Omicron.
A cette date (20/09/2022):, trois vaccins de ce type ont été autorisés par l’EMA et par la HAS
- le vaccin Spikevax bivalent (Moderna) composé de 2 ARNm, codant pour une fraction de la protéine Spike virale, encapsulés dans des nanoparticules lipidiques, 25µg ciblant la souche originale et 25µg le variant Omicron BA.1.
Une étude est en cours afin de comparer la réactogénicité et la sécurité d’emploi de cette nouvelle formulation utilisée comme second rappel (« quatrième dose ») avec celle du vaccin Spikevax monovalent. Une première analyse à 28 jours de suivi rapporte une réactogénicité, définie par la quantité d’anticorps neutralisant le virus produit par l’organisme, supérieure (environ 1,75 fois plus d’anticorps neutralisant le variant Omicron). Aucun différence en terme de sécurité n’est rapportée, cependant les effectifs faibles de l’étude (environ 400 patients) sont insuffisants pour détecter d’éventuels effets indésirables rares) (1,2) - le vaccin Comirnaty bivalent (Pfizer) , composé de 2 ARNm, codant pour une fraction la protéine Spike virale, 15µg ciblant la souche originale et 15µg le variant Omicron BA.1.
Aux USA, une études en cours chez les plus de 55 ans montre, après un mois de suivi, une supériorité concernant les titres d’anticorps neutralisant Omicron et une production d’anticorps contre la souche de Wuhan équivalente à celle du vaccin monovalent (environ 1,56, fois plus d’anticorps neutralisant le variant Omicron) (3). Comme précédemment, les effectifs (environ 600 patients) sont trop faibles pour détecter les effets indésirables rares. Des résultats sont prochainement attendus chez les moins de 55 ans. - le vaccin Comirnaty bivalent (Pfizer) , composé de 2 ARNm, codant pour une fraction de la protéine Spike virale, 15µg ciblant la souche originale et 15µg le variant Omicron BA.4-5.
Pour ce vaccin, seules les données précliniques, en première dose de rappel chez la souris, sont disponibles. Celles-ci montrent une meilleure immunogénicité vis à vis du variant BA. 4-5 du vaccin monovalent comparé au vaccin bivalent, mais ne présentent pas de données de comparaison directe de l’immunogénicité entre les vaccins bivalents adaptés BA.1 et BA.4-5, ni de comparaison avec le vaccin Comirnaty monovalent (3). Il n’y a pas de donnée de sécurité chez l’humain. Si ces données ne permettent habituellement pas de conclure, la HAS a estimé que, de par la grande similitude entre les différentes versions des vaccins ARNm, des comparaisons indirectes (entre des études différentes) permettaient raisonnablement d’autoriser cette formulation sans prendre de risque de sécurité, comme c’est par exemple le cas des vaccins antigrippaux.
 Ces vaccins sont recommandés par la HAS uniquement en dose de rappel, après un schéma vaccinal complet (quels que soient les vaccins initiaux) (2,3)
Ces vaccins sont recommandés par la HAS uniquement en dose de rappel, après un schéma vaccinal complet (quels que soient les vaccins initiaux) (2,3)
 Le vaccin Comirnaty monovalent reste seul indiqué avant 30 ans, en lien avec les données d’EPI-PHARE qui confirment que le risque de myocardite est plus important pour les personnes de moins de 30 ans et après la deuxième dose d’ARNm-1273 (Spikevax) que de BNT162b2 (Comirnaty), quel que soit le délai entre les doses ou le sexe des participants (bien que la dose d’ARNm ait été réduite de moitié dans le vaccin Moderna bivalent par rapport au vaccin monovalent Spikevax)
Le vaccin Comirnaty monovalent reste seul indiqué avant 30 ans, en lien avec les données d’EPI-PHARE qui confirment que le risque de myocardite est plus important pour les personnes de moins de 30 ans et après la deuxième dose d’ARNm-1273 (Spikevax) que de BNT162b2 (Comirnaty), quel que soit le délai entre les doses ou le sexe des participants (bien que la dose d’ARNm ait été réduite de moitié dans le vaccin Moderna bivalent par rapport au vaccin monovalent Spikevax)
 Les données définitives d’efficacité ne sont pas encore disponibles.
Les données définitives d’efficacité ne sont pas encore disponibles.
Références
- Chalkias S, Harper C, Vrbicky K, Walsh SR, Essink B, Brosz A, et al. A Bivalent Omicron-Containing Booster Vaccine against Covid-19. New England Journal of Medicine. 2022 Sep 16; https://www.nejm.org/doi/full/10.1056/NEJMoa2208343
- https://www.has-sante.fr/upload/docs/application/pdf/2022-09/rapport_evaluation_place_du_vaccin_spikevax_bivalent_original.omicron_ba.1_2022-09-
- https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2022-09-01/07-COVID-Swanson-508.pdf
- https://www.has-sante.fr/upload/docs/application/pdf/2022-09/rapport_evaluation_place_des_vaccins_cominarty_bivalents_original.omicron_ba.1_et_origninal._omicron_ba.4-5.pdf20_13-47-47_119.pdf
La réponse à cette question est issue d’un consensus d’experts.
 L’immunité collective
L’immunité collective
L’objectif de la vaccination est, bien entendu, de protéger l’individu vacciné, mais également de protéger l’ensemble de la population dans laquelle circule le virus. On appelle cela, l’immunité collective.
L’immunité collective est définie comme le seuil de protection de la population à partir duquel un individu infecté dans cette population pourrait contaminer moins d’une personne, ce qui, à terme, permettrait d’éliminer le virus de cette population. La protection de la population peut être obtenue par immunité naturelle (les patients infectés ont survécu et ont développé des anticorps contre l’agent infectieux), ou par la vaccination (les personnes ont développé des anticorps grâce au vaccin). Ensuite, le seuil à atteindre pour bénéficier de cette immunité collective dépend de la maladie et, d’en autre, de sa contagiosité. A titre d’exemple, il faut au moins 95% de la population vaccinée contre la Rougeole pour nous en protéger collectivement.
Compte-tenu des conséquences sanitaires de la pandémie de la Covid-19, il est éthiquement inconcevable de ne compter que sur l’immunité naturelle pour obtenir une immunité collective.
Ainsi, il est plus que nécessaire de vacciner le plus largement possible, afin d’atteindre rapidement ce seuil de protection collective. A ce jour, ce seuil pour la Covid-19, n’est pas encore établi avec certitude, car il dépend de multiples facteurs, mais d’après l’Institut Pasteur, il devrait se situer autour des 70%.
 La faisabilité
La faisabilité
Une fois un vaccin efficace et sûr obtenu, il faut encore pouvoir être en capacité de vacciner le plus largement possible, et le plus justement possible.
Ainsi, depuis le mois de mai 2020, l’OMS a mis en place l’ACT ACCELERATOR, permettant d'accélérer les recherches et la mise à dispositions entre autres des vaccins et de façon équitable dans le monde.
A l’échelle nationale, la Haute Autorité de Santé a émis des recommandations quant à l’ordre dans lequel la population française pourra être vaccinée. La vaccination en France devra donc commencer par les résidents d’EHPAD et les professionnels de santé en première ligne face à la COVID-19. L’ordre prévisionnel de vaccination complet est disponible ici : https://www.has-sante.fr/jcms/p_3221237/fr/vaccins-covid-19-quelle-strategie-de-priorisation-a-l-initiation-de-la-campagne
 Quel impact ?
Quel impact ?
La vaccination a eu un impact très important en santé publique. Une étude aux Etats-Unis rapporte que la vaccination contre la COVID-19 a permis de prévenir environ 27 millions d'infections, 1,6 millions d'hospitalisations et 235 000 de décès entre le 1er décembre 2020 et le 30 septembre 20211.
Références :
- https://www.pasteur.fr/fr/espace-presse/documents-presse/qu-est-ce-que-immunite-collective
- https://www.who.int/fr/news-room/q-a-detail/herd-immunity-lockdowns-and-covid-19
- https://www.who.int/publications/m/item/access-to-covid-19-tools-(act)-accelerator
- Estimated Number of COVID-19 Infections, Hospitalizations, and Deaths Prevented Among Vaccinated Persons in the US, December 2020 to September 2021, JAMA Network Open, 2022;5(7):e2220385. https://doi.org/10.1001/jamanetworkopen.2022.20385
Un nouveau rapport édité à partir des données de santé françaises et réalisé par le groupement d'intérêt scientifique EPI-PHARE, démontre l'efficacité de la dose de rappel contre les hospitalisations pour Covid-19.
L'analyse de ces données montre une efficacité de la première dose de rappel vaccinal par un vaccin à ARNm (soit la troisième injection) de plus de 80 % contre les hospitalisations, comparativement à la population n'ayant pas reçu de rappel. Cette efficacité est rapportée quel que soit le vaccin utilisé : Comirnaty® ou Spikevax®. La dose de rappel a donc permis de réduire par cinq le risque d'hospitalisation en cas d'infection par la Covid-19 par rapport à la population non vaccinée avec un rappel.
Cette analyse a été menée lors de la vague épidémique à l'automne 2021, au cours de laquelle les variants Delta puis Omicron ont circulé. Cette efficacité élevée de ce rappel vaccinal contre les hospitalisations s’élève à 85 % en période de circulation Delta et à 81% pour Omicron. Cette protection persiste donc quels que soient les variants.
L'analyse démontre également que cette protection diminue au cours du temps après le premier rappel avec une efficacité de 89 % dans les 2 mois suivant le rappel contre 78 % au-delà de 4 mois de rappel.
 Malgré cette diminution de protection au cours du temps, ces résultats montrent l’intérêt de cette troisième dose avec une protection vaccinale importante contre l’hospitalisation liée à la COVID-19.
Malgré cette diminution de protection au cours du temps, ces résultats montrent l’intérêt de cette troisième dose avec une protection vaccinale importante contre l’hospitalisation liée à la COVID-19.
Référence
Rapport EPIPHARE 7 Juillet 2022 Efficacité de la dose de rappel contre les hospitalisations pour Covid-19 https://www.epi-phare.fr/rapports-detudes-et-publications/rappel-vaccination-covid-19/ (PDF)
La réponse à cette question est issue d’un consensus d’experts.
Avant la mise sur le marché (AMM)
Il semble important de rappeler que comme pour tout médicament, la sécurité d’emploi d’un vaccin fait partie intégrante de chacune des étapes de son développement, au même titre que l’évaluation de son efficacité. D’ailleurs, cette considération implique généralement d’inclure suffisamment de personnes dans les essais cliniques, et de les suivre sur une durée suffisante pour s’assurer d’objectiver un profil de tolérance représentatif, et de pouvoir mettre en évidence les effets indésirables moins fréquents et inattendus.
Ce n’est qu’à la condition d’une balance “bénéfices-risques” favorable, établie sur les critères d’efficacité et de sécurité, qu’un vaccin, ou tout autre médicament, peut obtenir son autorisation de mise sur le marché (AMM).
Toutefois, compte tenu du relativement faible nombre de personnes incluses dans les essais cliniques et de la durée courte du suivi, seuls les effets les plus fréquents et de survenue précoce sont susceptibles d’être détectés (par exemple, si l’étude a inclus 10 000 personnes, un effet qui surviendrait chez 1 patient sur 100 000 n’a que très peu de chance de survenir). L’absence de signal dans les essais n’est donc pas suffisante pour conclure à l’absence de risque.
Une fois l’AMM obtenue
Une fois sur le marché, la surveillance du médicament, du vaccin, ne s’arrête pas : c’est ce qu’on appelle la phase IV du développement, où intervient la pharmacovigilance. En effet, dans des conditions d’utilisation “en vie réelle”, sur une plus large population et plus variée (personnes âgées, femmes enceintes, allaitantes, enfants, personnes atteintes d’une maladie chronique…), que dans le cadre des essais cliniques, des effets rares, complexes (liés au terrain du patient ou à des interactions médicamenteuses par exemple), ou tardifs peuvent être mis en évidence.
Ce suivi en vie réelle permet de faire émerger d’éventuels effets indésirables rares mais aussi d’évaluer de nouveaux critères de jugement non pris en compte au cours des essais clinique comme par exemple, dans le cas de la Covid-19, l’impact de la vaccination sur les hospitalisations, sur les hospitalisations en unité de soins intensifs, sur la mortalité ou sur la transmission virale.
Tout l’enjeu de la pharmacovigilance est donc de garantir que la balance “bénéfices-risques” du médicament, du vaccin, reste positive dans ses conditions d’utilisation dans la population, et ce durant toute la vie du vaccin. Cette balance n’est pas le fruit d’une formule mathématique mais l’aboutissement d’une appréciation collégiale prenant en compte de multiples paramètres et les incertitudes qui y sont liées ; elle est au cœur de discussions d’experts qui conduisent à formuler les recommandations vaccinales. Elle doit être actualisée régulièrement, au vu des connaissances apportées par la pharmacovigilance et la pharmaco-épidémiologie mais également parce qu’elle dépend du contexte épidémique (circulation actuelle et prévue du virus ainsi que l’évolution de la maladie). De plus, elle doit être évaluée différemment selon les sous-groupes de la population en prenant en compte notamment l’âge et la présence de comorbidités. En cas de mise en évidence d'un nouveau risque, des mesures de minimisation des risques peuvent être mises en place. Par exemple, si on se rend compte qu’une population définie est plus à risque de faire un effet indésirable particulier avec un vaccin précis, on pourra contre-indiquer ce vaccin à cette population, et on lui recommandera plutôt un autre vaccin qui n’est pas à risque de provoquer cet effet indésirable.
![]() Pour en savoir plus sur la pharmacovigilance : reportez-vous à la question #153.
Pour en savoir plus sur la pharmacovigilance : reportez-vous à la question #153.
Ainsi, en France, la sécurité des vaccins de la Covid-19 commercialisés fait l’objet: d’une part, d’un suivi en pharmacovigilance, via les Centres Régionaux de Pharmacovigilance (CRPV), et d’autre part du suivi systématique d’une cohorte de patients. Tous deux sont sous la responsabilité de l’Agence Nationale de Sécurité du Médicament et des Produits de Santé (ANSM).
Le suivi de pharmacovigilance en France s’intègre dans le plan de gestion des risques coordonné par l’Agence Européenne du Médicament (EMA). De plus, la sécurité sera surveillée au niveau mondial par l’Organisation Mondiale de la Santé (OMS) qui centralise le suivi à Uppsala, en Suède.
En pratique, pour les vaccins de la COVID-19
Pour permettre aux CRPV de détecter des signaux, il faut que les effets indésirables soient déclarés. Cette déclaration peut être faite par les professionnels de santé ou par les patients eux-mêmes.
Attention : l’objectif n’est pas de faire une revue exhaustive des effets indésirables bénins déjà connus et étudiés dans le cadre des essais cliniques, mais de mettre en évidences des effets indésirables graves et/ou nouveaux, ayant conduit à une consultation médicale ou à une hospitalisation.
Ainsi, il n’est pas pertinent voire même contre-productif de déclarer la survenue d’effets connus et bénins, comme la survenue d’une fièvre modérée, ou de maux de têtes par exemple. Ceci risquerait d’engorger le système et de retarder la détection d'effets indésirables graves ou nouveaux.
Au 18 février 2022, les vaccins contre la Covid-19 avaient conduit à 153 452 déclarations analysées et saisies par les CRPV, soit une activité 4 à 6 fois plus importante (selon les centres) que la normale. Parmi ces déclarations, 969 cas marquants ou potentiels signaux ont été transmis à l’ANSM en 2021.
|
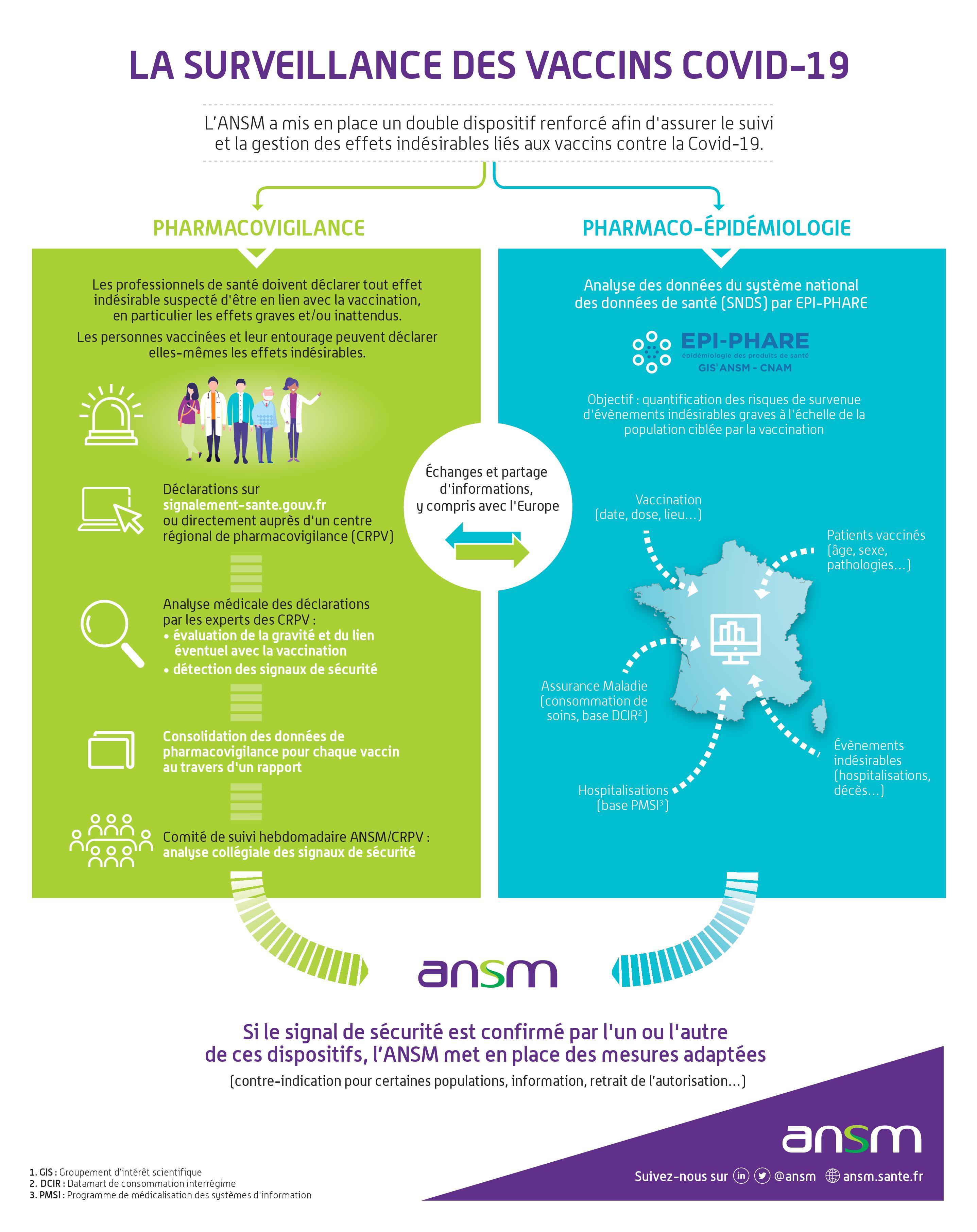 |
Afin d’aider les CRPV dans leur mission, des moyens humains supplémentaires ont été demandés. Mais ce n’est pas la seule aide dont ils vont disposer.
A partir de la mi-janvier, un système d’intelligence artificielle a été déployé. L’objectif n'est pas de remplacer l’expertise humaine mais de fluidifier la chaine d’analyse. En effet, l’intelligence artificielle intervient entre la déclaration des patients via le portail de signalement des événements sanitaires indésirables https://signalement.social-sante.gouv.fr/ et l’expertise des pharmacovigilants des CRPV (les déclarations provenant des médecins sont analysées en priorité sans passer par ce système).
L’intelligence artificielle transforme dans un premier temps les verbatims contenus dans les déclarations des patients en termes médicaux selon la classification MedDRA utilisée dans les CRPV. Ensuite, elle analyse ces termes pour trier les déclarations « graves » et « non graves », sans juger du rôle qu’a joué le vaccin dans la survenue de l’effet. Ceci permet aux pharmacovigilants des CRPV de prioriser leurs analyses, et ainsi d’être plus réactifs dans la mise en évidence de signaux.
Les déclarations non urgentes seront traitées dans un deuxième temps.
Pour information, l’intelligence artificielle stocke uniquement les données anonymisées, et le logiciel est régit par le cahier des charges de l’ANSM en termes de sécurités des données.
Le système a également fait preuve d’une certaine agilité pour pouvoir faire face aux conditions changeantes de la vaccination, tel que le développement de la vaccination hétérologue en raison des changements d’indication pour certains vaccins.
Pour des informations détaillées sur la procédure de suivi, voir la QR13
Ce dispositif de surveillance a représenté une charge de travail considérable pour les CRPV, dont les équipes restreintes se sont mobilisées.
Grâce à cette expertise pharmacologique, la France avait émis en avril 2022 un total de 49 signaux pour les différents vaccins autorisés (17 concernant Comirnaty, 14 pour Spikevax, 13 pour Vaxzevria et 5 pour Jcovden), dont 19 avaient été lancés par la France seule ou en premier. La France est le sixième contributeur du programme VigiBase de l’OMS et parmi les trois premiers en ce qui concerne l’informativité, ce qui témoigne de la performance du système français. Au niveau national, ce sont 60 rapports d’expertise (20 pour Comirnaty, 17 pour Vaxzevria, 17 pour Spikevax et 6 pour Jcovden) qui ont été réalisés, ainsi que 18 rapports sur des problématiques spécifiques.
Plusieurs rapports publics ont démontré l’efficacité de la vaccination avec un niveau élevé, notamment via l’impact de la vaccination sur le risque de formes graves chez les personnes âgées de 50 à 74 ans [3] ainsi que celles âgées de 75 ans et plus [4]
Ces études ont également permis de mettre en évidence une moindre efficacité du vaccin Jcovden® sur le risque d’hospitalisation en comparaison avec le vaccin Comirnaty® (Pfizer-BioNTech) et d’identifier les facteurs de risque résiduel de forme grave malgré la vaccination : âge, immunodépression, polypathologie [5].
Références :
- https://www.ansm.sante.fr/Dossiers/COVID-19-Vaccins/COVID-19-Les-vaccins/
- https://www.ansm.sante.fr/S-informer/Points-d-information-Points-d-information/Campagne-de-vaccination-contre-la-Covid-19-L-ANSM-deploie-son-dispositif-de-surveillance-renforcee-Point-d-Information
- M.-J. Jabagi et al., Estimation de l’impact de la vaccination sur le risque de formes graves de Covid-19 chez les personnes de 50 à 74 ans en France à partir des données du Système National des Données de Santé », 2021 https://www.epi-phare.fr/rapports-detudes-et-publications/impact-vaccination-covid-octobre-2021/
- K. Bouilon et al., « Estimation de l’impact de la vaccination chez les personnes âgées de 75 ans et plus sur le risque de formes graves de Covid-19 en France à partir des données du Système National des Données de Santé (SNDS) – actualisation jusqu’au 20 juillet 2021 », https://www.epi-phare.fr/rapports-detudeset-publications/impact-vaccination-covid-octobre-2021/
- Rapport OPECST, Sénat, Juin 2022 (Rapport (https://www2.assemblee-nationale.fr/content/download/473079/4608021/version/1/file/rapport_EI+vaccins+covid+sec_VF.pdf et Synthèse : https://www2.assemblee-nationale.fr/content/download/473106/4608258/version/1/file/Synthese_rapport_effets_indesirables_VF.pdf)
Contexte : l’administration concomitante, de vaccins COVID-19 et contre la grippe réduirait la charge de travail des systèmes de santé.
Une étude de non-infériorité en cours d’évaluation a évalué la sécurité de l’administration concomitante des deux vaccins ainsi que leur immunogénicité.
Des adultes ayant reçu une dose unique de ChadOx1 ou BNT162b2 ont été recrutés dans 12 sites au Royaume-Uni et ont été randomisés 1 :1 pour recevoir l’administration concomitante d’un vaccin contre la grippe adapté à leur âge ou d’un placebo, en même temps que le second vaccin COVID-19.
Les 679 participants ont été suivis jusqu’à 6 semaines.
Au total, des patients ont reçu aléatoirement soit le vaccin COVID-19 seul, soit le vaccin COVID-19 associé à un vaccin contre la grippe.
Le critère d’évaluation principal était une ou plusieurs réactions systémiques rapportées par les participants dans les sept jours suivant la ou les premières vaccinations.
La plupart des réactions étaient légères à modérées, les réactions systémiques étaient similaires entre les groupes randomisés. Un événement indésirable grave, une hospitalisation pour maux de tête sévères, a été considéré comme liée à l'intervention de l'essai. Les réponses immunitaires n'ont pas été affectées.
 Pour conclure : la vaccination concomitante grippe et COVID-19 ne modifie pas la réactogénicité et la réponse immunitaire comparativement à une administration séparée de 3 semaines entre ces deux vaccins.
Pour conclure : la vaccination concomitante grippe et COVID-19 ne modifie pas la réactogénicité et la réponse immunitaire comparativement à une administration séparée de 3 semaines entre ces deux vaccins.
Les injections doivent être réalisées sur des sites différents (deux bras différents) afin de pouvoir différencier les réactions au point d’injection.
Bibliographie :
Lazarus R. and al. Safety and immunogenicity of concomitant administration of COVID-19 vaccines (ChAdOx1 or BNT162b2) with seasonal influenza vaccines in adults in the UK (ComFluCOV): a multicentre, randomised, controlled, phase 4 trial. The Lancet November 11, 2021. DOI:https://doi.org/10.1016/S0140-6736(21)02329-1
La réponse à cette question a fait l’objet de recommandations par plusieurs sociétés savantes.
Concernant les patients ayant des antécédents d’allergies
L’administration d’un vaccin ARNm contre la COVID-19 est contre-indiqué en cas de réaction anaphylactique sévère confirmé ou fortement suspectée suite à la première dose d’un vaccin à ARNm contre la COVID-19 ou à l’un de ses composants (y compris le polyéthylène glycol (PEG) et le polysorbate en raison d’hypersensibilités croisées potentielles avec les PEG) [1]. Une réaction anaphylactique se définit comme « une réaction d’hypersensibilité systémique, sévère et potentiellement fatale, survenant brutalement suite à l’exposition à un allergène » [2]. Ces réactions surviennent en quelques minutes à quelques heures et associent à des degrés divers une éruption à type d’urticaire, un gonflement des muqueuses, une atteinte respiratoire, une hypotension artérielle voire des troubles digestifs. Elles sont classées en 4 grades (classification de Ring et Messmer). On parle de réactions sévères pour les grades II et plus : comportant une atteinte multiviscérale modérée (grade II) ou sévère (grade III) jusqu’à l’arrêt circulatoire et/ou respiratoire (grade IV) [1].
La vaccination peut avoir lieu sans l’avis d’un allergologue dans les situations suivantes [1,3] :
- Allergie à un pneumallergène (pollens, acariens, poils d’animaux …) : Rhinite, conjonctivite, asthme allergique.
- Allergie à un médicament oral : urticaire, angiodème, anaphylaxie*, réactions retardées comprenant les toxidermies même grave (DRESS, syndrome de Lyell ou de Steven Johnson), antécédents familiaux allergiques, eczéma de contact, urticaire ou angiodème chronique, angiodème bradykinique sans antécédent de réaction anaphylactique.
- Allergie au latex: urticaire, angiodème, eczéma, anaphylaxie*.
- Allergie aux venins d’hyménoptères (guêpes, abeilles, frelons) : urticaire, réaction au site d’injection, anaphylaxie*.
- Allergie alimentaire: syndrome oral, urticaire, eczéma, anaphylaxie*.
*La durée de surveillance recommandée après la vaccination est de 30 minutes.
Existe-t-il des contre-indications à certains traitements ?
Non.
Il n’a pas été observé au cours des essais de phase III de différences d’efficacité ou de tolérance chez les patients ayant un/des traitement(s) chronique(s). A l’heure actuelle la vaccination contre la COVID-19 est recommandée chez des patients sous traitements chroniques.
Pour rappel, les facteurs de risques individuels de développer une forme grave de la maladie sont les suivants : personne âgée, obésité, BPCO et insuffisance respiratoire, hypertension artérielle compliquée, insuffisance cardiaque, diabète de type 1 et 2, insuffisance rénale chronique, cancers récents de moins de trois ans, transplantation d’organe solide et de cellules souches hématopoïétiques et trisomie 21 [4].
Références
- Fiche Info vaccination par un vaccin ARNm contre la COVID-19 : Que faire en cas d’antécédent « d’allergie ». RFCRPV. Janvier 2021.
- HA Sampson and all. Second symposium on the definition and management of anaphylaxis : Summary report – second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium. Ann Emerg Med. 2006. https://doi.org/10.1016/j.annemergmed.2006.01.018
- Vaccination contre la COVID-19 et antécédents allergiques. Janvier 2021. https://sfa.lesallergies.fr/vaccination-contre-la-covid-19-et-antecedents-allergiques/
- https://solidarites-sante.gouv.fr/soins-et-maladies/maladies/maladies-infectieuses/coronavirus/tout-savoir-sur-la-covid-19/article/personnes-a-risques-reponses-a-vos-questions
L’injection des vaccins contre la COVID-19 est réalisée par une voie intramusculaire, le plus souvent au niveau de l’épaule (muscle deltoïde). L’ARNm injecté entre alors dans le cytoplasme des cellules présentes localement. Il est ensuite traduit en protéines ‘spicules, exprimées à la surface cellulaire/des virus. Ces protéines sont ensuite prises en charge par des cellules particulières du système immunitaire, appelées cellules présentatrices de l’antigène. Ces cellules sont les principales cellules dans lesquelles on retrouve ensuite l’ARN et la protéine. Ces cellules vont ensuite migrer dans les ganglions lymphatiques. L’ARN n’est ensuite plus détectable au bout de 3 jours.
Références
Lindsay, K.E., Bhosle, S.M., Zurla, C. et al. Visualization of early events in mRNA vaccine delivery in non-human primates via PET–CT and near-infrared imaging. Nat Biomed Eng 3, 371–380 (2019). https://doi.org/10.1038/s41551-019-0378-3
Zhang NN, et al. A Thermostable mRNA Vaccine against COVID-19. Cell. 2020 Sep 3;182(5):1271-1283.e16. doi: https://doi.org/10.1016/j.cell.2020.07.024
![]() Il est nécessaire de prendre rendez-vous auprès d’un centre de vaccination près de chez vous (se référer à l’item 14 de cette FAQ pour s’assurer d’être dans la population éligible à la vaccination). Voir ce site pour trouver un lieu de vaccination : https://sante.fr/carte-vaccination-covid
Il est nécessaire de prendre rendez-vous auprès d’un centre de vaccination près de chez vous (se référer à l’item 14 de cette FAQ pour s’assurer d’être dans la population éligible à la vaccination). Voir ce site pour trouver un lieu de vaccination : https://sante.fr/carte-vaccination-covid
Le jour de votre rendez-vous, vous devrez venir avec votre pièce d’identité et votre carte vitale. Vous bénéficierez d’une consultation pré vaccinale au centre de vaccination pour s’assurer de l’absence de contre-indication ou de la nécessité de précautions d’emploi. Durant cette consultation, vous aurez à répondre aux questions suivantes:
- Avez-vous déjà présenté une réaction anaphylactique (allergie grave) suite à une vaccination, un médicament ou toute autre substance (aliment) ?
En cas d’antécédents de réactions grave de type anaphylactique (réaction allergique immédiate et généralisée comprenant des atteintes respiratoires, digestives, etc.), la vaccination n’est pas recommandée. De même la 2ème dose du vaccin n’est pas recommandée en cas de réaction anaphylactique suite à la 1ère dose. - Etes-vous allergiques aux PEG ?
Les molécules PEG (polyéthylène glycol) sont largement utilisées dans la composition de médicaments : on les retrouve comme laxatif (macrogol), mais également dans la composition de médicaments administrés par voie injectable pour augmenter leur durée de vie (facteurs de croissance hématopoïétique, anti-cancéreux, etc.). Ces molécules rentrent dans la composition du vaccins ARNm, et pourraient être impliquées dans les réactions anaphylactiques observées très rares (environ 1/100 000 vaccinations - voir QR 11 de cette FAQ). - Pour les femmes : êtes-vous enceintes ou allaitez-vous actuellement ?
Au vu du manque de données, l’administration du vaccin pendant la grossesse ou l’allaitement, n’est pas recommandé pour le moment. Elle sera toutefois à discuter si un risque de forme grave existe du fait de certaines comorbidités. - Etes-vous sous traitement anticoagulant ?
Les traitements anticoagulants, les thrombopénies ou les troubles de la coagulation ne sont pas une contre-indication stricte à la vaccination par voie intra musculaire. La prudence est requise en raison d’un risque de saignement ou d’ecchymose, il est recommandé d’utiliser une aiguille fine, suivie d’une compression forte et prolongée (2 minutes). Toutefois, dans les cas de troubles sévères, il est nécessaire de se référer à son médecin afin d’évaluer les bénéfices/risques de la vaccination. - Avez-vous présenté une affection COVID-19 avec symptômes dans les 3 derniers mois ?
Il est nécessaire de respecter un délai minimal de 3 mois depuis l’apparition de symptômes au cours de l’affection COVID-19. Il n’est pas utile de réaliser de sérologie, car elle ne permet pas d’identifier les personnes potentiellement protégées contre le virus. - Présentez-vous actuellement un syndrome infectieux ?
Si oui, comme pour tous vaccins, la vaccination doit être reportée. - Avez-vous été cas contact dans les 14 derniers jours ?
Dans le cas où vous êtes cas contact, il est nécessaire de réaliser un test de dépistage. La vaccination pourra être envisagée si le ou les tests s’avèrent négatifs. - Avez-vous été vacciné contre la grippe saisonnière dans les 3 dernières semaines ?
Il est recommandé un intervalle minimum de 14 jours avant ou après toute autre vaccination. Il n’est pas conseillé de faire un autre vaccin dans l’intervalle de temps séparant les deux doses de la vaccination contre la COVID-19.
Etape de vaccination.
- L’injection est faite en intramusculaire généralement dans l’épaule (gauche si on est droitier)
- Une fois la vaccination effectuée : Surveillance post-vaccination pendant 15 minutes pour s’assurer de l’absence de réaction anaphylactique (voir item 11 de cette FAQ).
- Vous partirez avec un rendez-vous pour la deuxième injection qui est nécessaire pour que la vaccination soit pleinement efficace.
A savoir : la vaccination est prise en charge à 100% par l’Assurance maladie.
Références
- https://www.mesvaccins.net/web/vaccines/710-covid-19-mrna-vaccine-bnt162b2
- https://www.vidal.fr/actualites/26442-premier-vaccin-contre-la-covid-19-disponible-en-france-comirnaty-en-pratique.html
- https://www.infectiologie.com/UserFiles/File/groupe-prevention/covid-19/vaccins-covid-19-questions-et-reponses-spilf-24dec2020.pdf
- https://www.has-sante.fr/upload/docs/application/pdf/2020-12/reponses_rapides_dans_le_cadre_de_la_covid-19_-_consultation_de_prevaccination_contre_la_covid-19_en_soins_de_premier_recour.pdf
La réponse à cette question a fait l'objet d'un consensus d'experts.
Oui, à l’heure actuelle la vaccination contre la COVID-19 est recommandée chez des patients sous traitements chroniques. Il n’a pas été observé au cours des essais de phase III de différences d’efficacité ou de tolérance chez les patients ayant un/des traitement(s) chronique(s).
Les facteurs de risques individuels de développer une forme grave de la maladie (personne âgée, obésité, BPCO et insuffisance respiratoire, hypertension artérielle compliquée, insuffisance cardiaque, diabète de type 1 et 2, insuffisance rénale chronique, cancers récents de moins de trois ans, transplantation d’organe solide et de cellules souches hématopoïétiques et trisomie 21) sont un critère de priorisation de la vaccination.
Concernant les traitements immunosuppresseurs, les patients sous traitements immunosuppresseurs n’ont pas été inclus dans les essais de phase III des vaccins commercialisés à ce jour. Toutefois les vaccins à ARN présentent l’avantage d’absence de manipulation du virus contrairement aux vaccins vivants atténués qui sont eux contre-indiqués chez les patients immunodéprimés.
La réponse à cette question est issue d’un consensus d’experts.
L’objectif est de détecter des effets nouveaux et/ou graves qui peuvent être des signaux de sécurité, non identifiés dans les essais cliniques. Cette détection doit se faire en temps réel et s’appuie sur le principe de la notification spontanée des effets indésirables par les acteurs du système de soins, professionnels de santé et patients.
Les déclarations d’effets indésirables liés aux vaccins contre la COVID-19 gérées par les CRPV puis enregistrées dans la base française de pharmacovigilance et les déclarations enregistrées par les firmes commercialisant les vaccins seront analysées dans le cadre d’une enquête de pharmacovigilance mise en place par l’ANSM et confiée à des CRPV experts, nommés par l’ANSM. Ils sont au nombre de 2 par vaccin. Pour le vaccin Comirnaty® (BNT162b2), il s'agit des centres de Bordeaux et Marseille
Ce travail de synthèse permettra d’avoir une analyse globale afin de détecter de nouveaux signaux potentiels de sécurité : nouveaux effets, gravité inattendue, facteurs de risques potentiels…
Ces analyses feront l’objet d’un rapport hebdomadaire par les CRPV experts qui sera discuté au sein d’un comité de suivi constitué par l’ANSM. Ce comité réunit des membres de l’ANSM et des représentants des CRPV. D’autres données seront également discutées afin de croiser les signaux : essais cliniques, veille documentaire scientifique et veille statistique de la base nationale de pharmacovigilance.
Il est également prévu des études de pharmacoépidémiologie basées sur les données du Système National des Données de Santé (SNDS). Ces études permettront également, si nécessaire, d’explorer des signaux identifiés par la pharmacovigilance.
L’ensemble de éléments analysés permettra de prendre des mesures de minimisation du risque adaptées, d’alerter, le cas échéant, l’EMA, les professionnels de santé et les patients et permettra également au Ministère chargé de la Santé d’adapter la stratégie de vaccination, si nécessaire.
Par ailleurs, en cas d’un signal détecté en France, ou à l’international, susceptible de conduire à une réévaluation du rapport bénéfice-risques des vaccins, les autorités compétentes des Etats membres de la communauté européenne s’informeront mutuellement afin de prendre des dispositions concertées.
Enfin, au cours de la première phase de vaccination, au niveau de chaque région, les CRPV seront en contact direct avec les établissements hébergeant des personnes âgées afin de recueillir les effets indésirables potentiels des vaccins.
Chaque semaine, l’ANSM publiera sur son site Internet les données de pharmacovigilance et les faits marquants, comme cela est fait pour l’enquête sur les médicaments utilisés dans la COVID-19 depuis mars 2020.
Pour en savoir plus, consultez le site du réseau français des CRPV
La réponse à cette question est issue d’un consensus d'experts.
On sait pour les personnes âgées que la réponse vaccinale est moins efficace du fait d’un système immunitaire moins actif (immunosénescence), c’est le cas pour le vaccin contre la grippe qui devient moins immunogène. L’efficacité de la réponse vaccinale est également moins longue dans le temps et c’est pourquoi des rappels sont nécessaires de manières plus précoces chez les personnes âgées, c’est le cas pour le vaccin Diphtérie-Tétanos-Poliomyélite.
La même question se pose pour les vaccins de la Covid-19, raison pour laquelle les essais cliniques de phase 3 incluent des sujets âgés ou à risque. L’objectif sera surtout de savoir si un type de vaccin doit préférentiellement être administré dans ces populations.
Références :
- Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3 .
- Flanagan KL, Best E, Crawford NW, Giles M, Koirala A, Macartney K, Russell F, Teh BW and Wen SCH (2020) Progress and Pitfalls in the Quest for Effective SARS-CoV-2 (COVID-19) Vaccines. Front. Immunol. 11:579250. https://doi.org/10.3389/fimmu.2020.579250
- Vaccination et personnes âgées : rapport du Haut Conseil de la Santé Publique - 2016
La réponse à cette question est issue d’un consensus d'experts.
A priori, non. Des vaccins contre un autre virus, le virus respiratoire syncytial, non commercialisés, peuvent aggraver les infections ultérieures lorsque le vacciné développe des anticorps non neutralisants. Pour la Covid-19, les données des premiers essais cliniques ne montrent pas de cas de maladie respiratoire aggravée, en particulier d’aggravation médiée par les anticorps. Ce risque est cependant particulièrement suivi par les autorités de santé avec les vaccins en cours de développement.
Références :
- Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3 .
Les vaccins à ARN (environ 20 % des candidats vaccins) font partie de la famille des vaccins à acide nucléique (voir la réponse 05)
Dans ces vaccins, l’information génétique de la protéine « spike » est contenue dans l’ARN. L’ARN étant une molécule instable, il est stabilisé dans des nanoparticules lipidiques* qui permettent également sa pénétration cellulaire et limitent sa dégradation dans la cellule. Cette technologie est récente, mais sert déjà à la conception d’autres vaccins comme celui du virus Zika ou du cytomégalovirus. Le principe est que l’ARN pénètre les cellules humaines et c’est la machinerie cellulaire qui produit la protéine « spike » d’intérêt. L’ARN ne pénètre pas dans le noyau de la cellule, et n’a donc pas la possibilité de s’insérer dans le génome. L’avantage est que l’on ne manipule à aucun moment de virus, et que les données disponibles à ce jour sont rassurantes en termes d’effets indésirables. L’inconvénient est que cela nécessite une gestion des stocks complexes (stockage dans des congélateurs), et que l’on a moins de recul qu’avec les autres types de vaccins.
* Une nanoparticule est une structure dont la taille est inférieure à 100 µm. Il existe 3 types de nanoparticules, les inorganiques (métalliques), polymères ou lipidiques. Les vaccins à ARN sont vectorisés par des nanoparticules lipidiques, c.à.d. composées de différents lipides. On utilise principalement des transporteurs lipidiques nanostructurés, mélange de lipides solides et liquides stabilisant le noyau lipidique.
Le développement des vaccins de la Covid-19 a utilisé toutes les technologies connues, parmi lesquelles on peut différencier 2 approches (figure) : l’utilisation de tout ou partie du virus, ou l’utilisation de son code génétique. Ceci explique qu’une grande variété de vaccins technologiquement très différents sont développés :
 Les vaccins inactivés.
Les vaccins inactivés.
Ceci consiste à cultiver le virus Sars-Cov-2 sur des cellules puis de l’inactiver (c’est une technique traditionnelle que l’on retrouve pour le vaccin de la poliomyélite ou de la grippe) avant de l’injecter. Ces vaccins sont administrés par voie intramusculaire et peuvent nécessiter un adjuvant pour stimuler la réponse immunitaire.
 Les vaccins vivants atténués.
Les vaccins vivants atténués.
Ceci consiste à injecter un virus Sars-Cov-2 dont la virulence est atténuée. L’avantage est que ces vaccins peuvent être administrés par voie nasale et procurer une protection des voies aériennes supérieures et donc protéger de l’infestation, et d’induire une forte réponse immunitaire sans adjuvant (historiquement, c’est par exemple le vaccin contre la rougeole). Par contre, l’énorme inconvénient est qu’il faut contrôler la virulence du vaccin, au risque de transmettre une maladie. Ces vaccins sont donc contre indiqués chez les patients immunodéprimés Il n’y a aujourd’hui que 3 vaccins de ce type en cours de développement.
 Les vaccins à sous-unité protéique (environ 33% des candidats vaccins)
Les vaccins à sous-unité protéique (environ 33% des candidats vaccins)
Appelés également vaccins à protéines recombinantes (c’est par exemple le virus contre l’hépatite B). Il s’agit d’injecter une partie du virus impliquée dans l’adhésion aux cellules humaines. Ces vaccins se différencient en 3 sous catégories :
- Les vaccins comportant la protéine « spike » qui permet l’ancrage du virus. Il s’agit de la majorité des vaccins développés.
- Les vaccins comportant uniquement la portion de la protéine « spike » qui se lie à son récepteur chez l’homme
- Les vaccins comportant des protéines « spike » assemblées pour former un faux virus, c’est ce qu’on appelle les vaccins à « virus-like-particles ». Ces vaccins permettent d’exposer de plus grandes quantités d’antigène au système immunitaire et sont plus immunogènes, permettant parfois de ne pas ajouter d’adjuvant.
L’avantage de ces vaccins est que leur processus de fabrication est connu et ne nécessite pas de virus vivant. Les inconvénients sont que cette technologie ne permet pas facilement de produire de grandes quantités de vaccins, et que leur immunogénicité modeste requiert la présence d’adjuvant pour stimuler le système immunitaire.
 Les vaccins à vecteurs viraux non répliquant (environ 25% des candidats vaccins).
Les vaccins à vecteurs viraux non répliquant (environ 25% des candidats vaccins).
Ces vaccins consistent en l’utilisation d’un autre virus modifié pour exprimer la protéine « spike » pouvant infecter les cellules mais pas se multiplier. Ils sont principalement à base d’adénovirus, un virus connu, stable. L’avantage est que l’on ne manipule pas de virus Sars-Cov-2, que le processus de fabrication est connu (c’est le principe du vaccin contre le virus de l’Ebola). L’inconvénient potentiel est que l’on peut avoir une immunité préalable contre le virus vecteur, ou la créer avant la seconde injection du vaccin. La version à vecteurs répliquant est moins avancée en recherche clinique et permet théoriquement une meilleure immunité. Il existe aussi quelques vaccins à vecteurs viraux inactivés (n’entrant pas dans les cellules et ne se multipliant pas).
 Les vaccins à acide nucléique :
Les vaccins à acide nucléique :
Il s’agit d’une nouvelle famille de vaccins. Aucun vaccin n’est commercialisé avec cette technique, mais leur développement est antérieur à la pandémie covid-19 :
- Les vaccins à ADN. Ils utilisent une partie du code génétique du Sars-Cov-2, intégré dans un morceau d’ADN bactérien circulaire (plasmide). Ils ont l’avantage de pouvoir être produits en grande quantité, mais posent le problème d’être souvent faiblement immunogènes. Il existe un risque théorique d’insertion dans le matériel génétique humain, qui n'est cependant pas retrouvé à ce jour. Quelques vaccins de ce type sont en développement.
- Les vaccins à ARN (environ 20 % des candidats vaccins). son traités dans la réponse 6
La réponse à cette question a fait l'objet d'un consensus d'experts.
Les vaccins sont des médicaments. Leur développement traditionnel est un processus long, nécessitant une moyenne de 15 ans avant la mise sur le marché.
Les étapes pré-cliniques :
La conception du vaccin et son évaluation initiale sont réalisées sur des modèles cellulaires et animaux. Ceci est suivi par des étapes plus formalisées d’exploration de l’efficacité et de la toxicologie sur des modèles animaux en parallèle de travaux sur le processus de fabrication.
Les étapes cliniques :
- Phase 1 : réalisation des premiers tests de sécurité chez l’homme, sur des petits effectifs.
- Phase 2 : réalisation d’études sur la recherche de la dose efficace.
- Phase 3 : évaluation de son efficacité et description de sa sécurité sur une population volontaire avec un effectif plus large.
Pendant ces différentes phases, on étudie l’immunogénicité du vaccin candidat. Une fois ces résultats obtenus, le dossier du vaccin est soumis à une autorité de santé compétente, la Food and Drug Administration aux Etats-Unis, l’European Medicines Agency en Europe avant mise sur le marché.
On voit donc que ce processus est long, complexe, et il fait l’objet d’une évaluation économique à chaque étape.
Références
Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3
La réponse à cette question a fait l'objet d'un consensus d'experts.
Le but de la vaccination est « d’imiter » une infection par le virus, en administrant une forme atténuée ou inactivée d’un agent infectieux (ou certains de ses composants) afin de provoquer une réaction du système immunitaire qui produira alors les anticorps nécessaires pour prévenir ou réduire les risques d’infection, de dissémination du pathogène ou encore réduire la dangerosité d’une infection.
Cette défense face à une infection ultérieure est maintenue par la persistance de cellules immunitaires mémoires (Lymphocytes B, Lymphocytes T CD4/CD8) produit au décours de la vaccination.
Suite à une nouvelle rencontre avec l’agent infectieux, des cellules, qu’on appelle cellules présentatrices de l’antigène vont capter cet agent infectieux afin de le présenter, via des antigènes (protéines présentes sur la face externe donc visible par le système immunitaire ou des toxines du pathogène), aux cellules immunitaires mémoires permettant une réponse rapide (3 à 5 jours) médier par des lymphocytes T CD8 dit tueurs, et des lymphocytes B producteurs d’anticorps en autre.
Dans le cadre du SARS CoV-2 la protéine la plus « visée » par les candidats vaccins est la protéine S (Spicule), protéine responsable de l’infection des cellules par le virus.
Références
- https://www.inserm.fr/information-en-sante/dossiers-information/vaccins-et-vaccinations
- Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3
La réponse à cette question a fait l'objet d'un consensus d'experts.
La pandémie à Sars-Cov-2 a nécessité une réponse beaucoup plus rapide que le schéma traditionnel. Cette accélération a été facilitée par plusieurs facteurs :
- Le plus important est le développement préalable de vaccins de deux « cousins » très proches du Sars-Cov-2, le Sars-Cov et le Mers-Cov. Ceci a permis d’utiliser toutes leurs données de conception et de production du vaccin pour les adapter au Sars-Cov-2. Ceci explique pourquoi la première étude clinique a eu lieu dès mars 2020.
- Le deuxième facteur est que le développement clinique a été réalisé de façon adaptative et beaucoup plus rapide, avec des essais de phase I/II progressant en phase III après analyses intermédiaires.
- Le troisième facteur très important est qu’un risque financier a été pris par les entreprises pour avancer plus vite sans une assurance de rentabilité à chaque étape. Un exemple assez frappant est que plusieurs entreprises produisent déjà la forme commerciale avant la fin de leurs études de phase III, ce qui permet un énorme gain de temps, mais aussi un énorme risque financier si les études ne sont pas concluantes.
- Enfin, le quatrième facteur est que les autorités de santé évaluent les dossiers des candidats vaccins en urgence et de façon continue, avant même que le dossier final soit abouti.
- Ces 4 facteurs ont permis d’accélérer l’intégralité du processus de développement et de production en conservant toutes les évaluations habituelles de leur sécurité.
Références :
Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3
Evaluation de nouveaux traitements, Vaccins
- Dernière mise à jour le .
