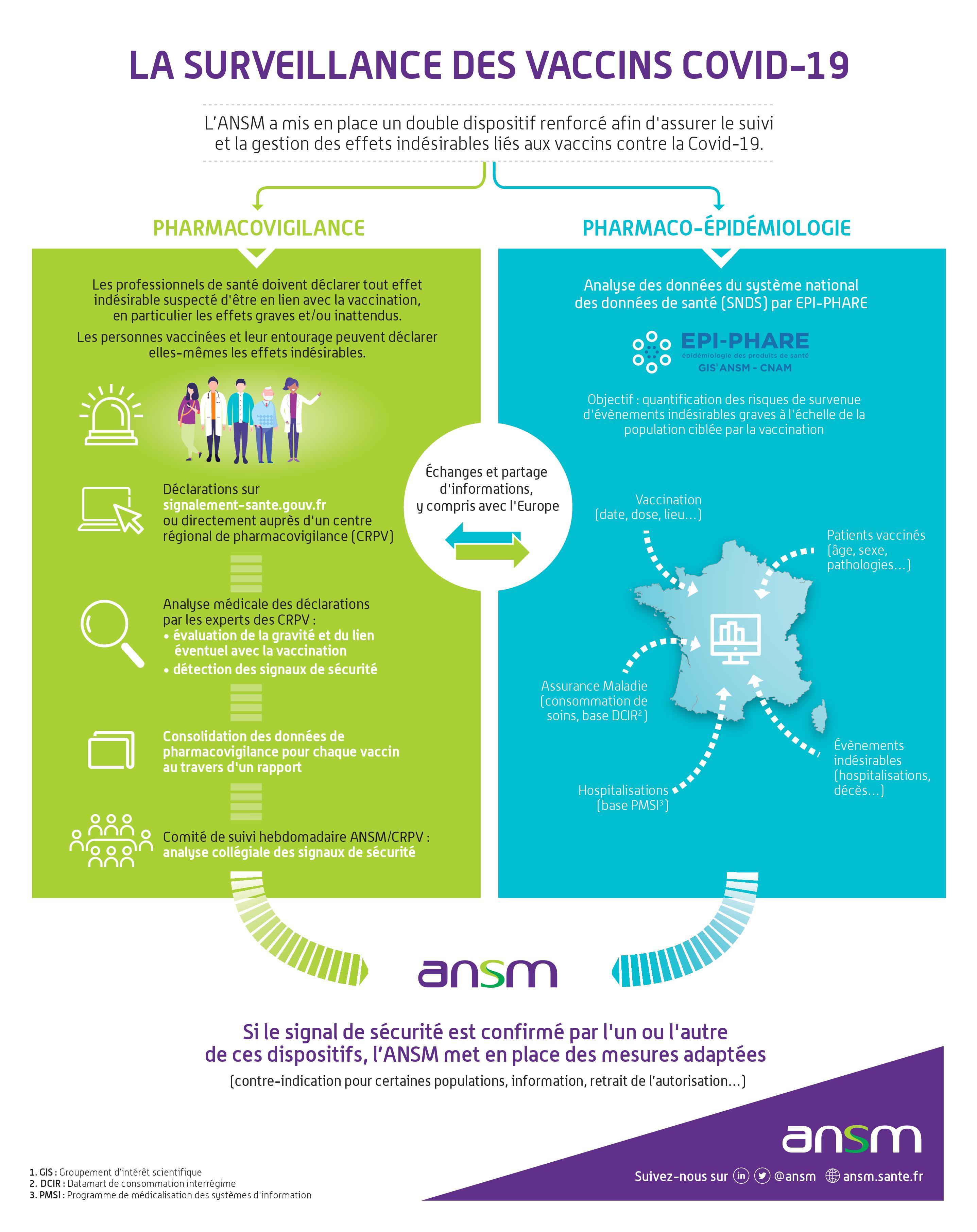
Concernant la grossesse :
 Oui, il est recommandé de se faire vacciner par un vaccin à ARNm (Pfizer-BioNtech ou Moderna) dès le 1er trimestre de grossesse [1]. La HAS, soutenue par le Collège National des Gynécologues et Obstétriciens Français, recommande une deuxième dose de rappel vaccinal chez les femmes enceintes, quel que soit le terme de la grossesse, lorsque la dose précédente date de plus de 6 mois. [2] Oui, il est recommandé de se faire vacciner par un vaccin à ARNm (Pfizer-BioNtech ou Moderna) dès le 1er trimestre de grossesse [1]. La HAS, soutenue par le Collège National des Gynécologues et Obstétriciens Français, recommande une deuxième dose de rappel vaccinal chez les femmes enceintes, quel que soit le terme de la grossesse, lorsque la dose précédente date de plus de 6 mois. [2]
|
Risque accru de covid grave pendant la grossesse
Plusieurs études révèlent que les femmes enceintes présentent un risque plus élevé de développer une forme grave de COVID-19 [3-6] avec un sur-risque de décès (risque relatif RR = 1,7) [3]. Les femmes enceintes présentant des comorbidités (surpoids, hypertension, diabète etc.) semblent présenter un risque accru de développer des formes sévères de la COVID-19, notamment au cours du 3ème trimestre de grossesse. La COVID-19 pendant la grossesse est également associé à un risque accru de complications spécifiques à la grossesse : pré-éclampsie, naissance prématurée et mortalité périnatale [6-10].
Efficacité et sécurité du vaccin ARNm pendant la grossesse
 Il a été montré que le vaccin par ARN est aussi efficace pour les femmes enceintes que pour la population générale [11].
Il a été montré que le vaccin par ARN est aussi efficace pour les femmes enceintes que pour la population générale [11].
 Les études chez l’animal n’ont pas mis en évidence d’effets délétères sur la gestation [12], le développement embryonnaire et fœtal. Chez la femme enceinte, une étude prospective publiée dans le NEJM parmi une cohorte de femmes entre 16 et 54 ans, vaccinées et enceintes ou enceintes après la vaccination par un vaccin à ARNm (Pfizer-BioNtech ou Moderna) n’a pas montré d’augmentation des effets indésirables locaux et systémiques dans cette population par rapport à la population générale. Dans une deuxième cohorte de 3958 femmes enceintes au moment de la vaccination par un vaccin à ARNm (Pfizer-BioNtech ou Moderna) l’étude ne retrouve pas d’augmentation des complications de la grossesse (avortement spontané, naissance prématurée etc.) par rapport à ceux attendus dans cette population [12]. Une étude canadienne publiée en aout 2022 sur près de 43000 femmes enceintes vaccinées par ARNm conclu à la même absence de sur risque. [13]
Les études chez l’animal n’ont pas mis en évidence d’effets délétères sur la gestation [12], le développement embryonnaire et fœtal. Chez la femme enceinte, une étude prospective publiée dans le NEJM parmi une cohorte de femmes entre 16 et 54 ans, vaccinées et enceintes ou enceintes après la vaccination par un vaccin à ARNm (Pfizer-BioNtech ou Moderna) n’a pas montré d’augmentation des effets indésirables locaux et systémiques dans cette population par rapport à la population générale. Dans une deuxième cohorte de 3958 femmes enceintes au moment de la vaccination par un vaccin à ARNm (Pfizer-BioNtech ou Moderna) l’étude ne retrouve pas d’augmentation des complications de la grossesse (avortement spontané, naissance prématurée etc.) par rapport à ceux attendus dans cette population [12]. Une étude canadienne publiée en aout 2022 sur près de 43000 femmes enceintes vaccinées par ARNm conclu à la même absence de sur risque. [13]
Ainsi, en France, la vaccination avec une deuxième dose de rappel (aussi appelée ‘‘quatrième dose’’) est recommandée pour les femmes enceintes. Quel que soit le terme de la grossesse.[1 et 2] Avec un espacement des doses de 6 mois.
Malgré ces données, une étude récente rapporte que la couverture vaccinale était nettement plus faible chez les femmes enceintes : 32 % des femmes ayant accouché en octobre 2021 avaient reçu deux doses de vaccin, contre 77 % pour l'ensemble des femmes [10].
Vaccination pendant l’allaitement :
 Oui, je peux poursuivre l’allaitement après une vaccination par un vaccin à ARNm (Pfizer-BioNtech ou Moderna). On ne retrouve pas de passage du vaccin chez l’enfant Oui, je peux poursuivre l’allaitement après une vaccination par un vaccin à ARNm (Pfizer-BioNtech ou Moderna). On ne retrouve pas de passage du vaccin chez l’enfant
|
Une étude réalisée à Singapour à montrer de très faible quantité d’ARNm, sans possibilité de différencier les résidus des ARNm fonctionnels, chez 4 des 35 femmes participantes (en moyenne 0.02% de la dose injectée). Aucun des enfants testés ne présentait d’ARNm dans le sang, probablement grâce à une dégradation dans le système digestif. [17]
En revanche, des anticorps de type A et IgG spécifiques anti SARS-CoV2 sont sécrétés dans le lait après la vaccination [18]. Par analogie avec d’autres maladies infectieuses (comme la coqueluche [19] ou la grippe), il est possible que les anticorps transmis à l’enfant par le lait lui expliquent cette protection observée chez les nouveaux nés de femmes vaccinées.
Au vu de ces éléments, la HAS stipule désormais (en compléments des recommandations de février 2021) que la vaccination par un vaccin à ARNm est envisageable chez une femme qui allaite.
Protection des nouveaux nés
Une étude norvégienne parue en juin 2022 [14], réalisée chez la population générale en période de prédominance des variants Delta puis Omicron, chez plus de 21000 enfants durant les 4 premiers mois de leur vie, montre un taux de contamination par le coronavirus (PCR positive) inférieur chez les nouveaux nés de mère vaccinée par vaccin à ARNm : Lors de la période de prédominance du variant Delta, le nombre d’infection était inférieur de 64% dans le groupe des nouveau nés de mères vaccinées (1.2 vs 3 cas par 10 000 jours de suivi) et inferieur de 27% lors de la période de prédominance du variant Omicron (7 vs 10.9 cas par 10 000 jours de suivi). Le nombre de doses de vaccins semblait corrélé à une plus grande diminution de la contamination. Ce résultat est important puisqu’il suggère un effet protecteur passif du nouveau-né par la vaccination maternelle, alors que ces enfants présentent des infections plus sévères que les enfants plus âgés et qu’il n’existe pas encore de vaccin pour les moins de 5 ans. Une autre étude américaine [15] parue en juillet 2022, confirme ces données et les précise en montrant une diminution du nombre et de la gravité des infections covid (moins de recours aux soins intensifs) chez les nouveaux nés de mères vaccinées avec deux doses. La protection semble maximale lorsque la deuxième injection est réalisée le troisième trimestre. La transmission d’anticorps par le sang du cordon et le lait maternel ainsi que la baisse de transmission du coronavirus par les mères vaccinées, peuvent expliquer ce résultat. Cette étude ne mettait pas en évidence plus d’effets indésirables chez les femmes vaccinées.
Une étude canadienne parue en février 2023 [20] réalisée dans la population générale en période de prédominance des variants Delta puis Omicron, chez plus de 13000 enfants durant les 6 premiers mois de leur vie montre que les nourrissons des femmes qui ont reçu deux doses de vaccin mRNA dont une des deux doses a été réalisée pendant sa grossesse, bénéficient d'un effet protecteur du vaccin de 95% (IC95% 88-98%) contre l’infection du variant Delta et de 45% (IC95% 37 à 53%) contre l’infection du variant Omicron. Cette efficacité est augmentée jusqu’à 73% (IC95% 61-80%) contre l’infection du variant Omicron si la mère a reçu une 3ème dose de vaccin mRNA pendant leur grossesse. Cette étude montre aussi que la protection est plus élevée lorsque la deuxième dose est réalisée au troisième trimestre (53%(IC95% 42-62%)) par rapport au première (47%(IC95 31-59%) ou deuxième (37%(IC95% 24-47%) trimestre. Ces résultats sont cohérents avec ceux de l'étude américaine citée au-dessus. En revanche, l’efficacité de 2 doses du vaccin contre l’infection du variant Omicron chez les nouveau-nés a diminué de 57% (IC95% 44 à 66%) entre la naissance et 8 semaines à 40% (IC95% 21 à 54%) après l’âge de 16 semaines. Ainsi, deux doses de vaccin mRNA chez la mère pendant la grossesse permettent réduire le risque d’hospitalisation des nouveau-nés due à cette infection; l’efficacité est de 97% (IC95% 73-100%) contre le variant Delta et de 53% (IC95% 39-64%) contre le variant Omicron. L’effet protecteur est de 80% (IC95% 64-89%) contre le variant Omicron si la mère a reçu une troisième dose du vaccin pendant sa grossesse.
Une étude publiée dans le JAMA en septembre 2023 [21] décrit l’apparition d’infection par les variants Omicron, dont le variant XBB, chez 7292 enfants de moins de 7 mois. Il est rapporté trois modalités de couverture vaccinale de la mère. La première est l’absence de vaccination, la seconde est la réalisation d’un schéma vaccinal avant la grossesse, et la troisième est l’injection d’une dose booster (2nd ou 3ème dose) pendant la grossesse. L’étude rapporte une efficacité de 41,5% (IC 95%, 22,8%-55,7%) contre l’infection à Omicron pour le seul groupe dont la mère a reçu au moins une dose booster pendant la naissance, et l’absence d’effet protecteur chez l’enfant d’un schéma vaccinal réalisé avant la grossesse par rapport aux femmes n’ayant pas été vaccinées. L’étude suggère également une protection contre le variant XBB mais uniquement chez les femmes ayant bénéficié d’une 3ème dose pendant la grossesse.
 La vaccination de la mère pendant la grossesse protège le nouveau-né d’une forme grave de Covid, y compris contre les variants d'apparition récente, dont le variant XBB La vaccination de la mère pendant la grossesse protège le nouveau-né d’une forme grave de Covid, y compris contre les variants d'apparition récente, dont le variant XBB
|
Références :
1. La stratégie vaccinale et la liste des publics prioritaires. Ministère des Solidarités et de la Santé. 2022 https://solidarites-sante.gouv.fr/grands-dossiers/vaccin-covid-19/publics-prioritaires-vaccin-covid-19
2. https://www.has-sante.fr/jcms/p_3352553/fr/covid-19-une-dose-de-rappel-vaccinal-additionnelle-ouverte-a-davantage-de-personnes-et-des-delais-precises
3. Zambrano LD, Ellington S, Strid P, Galang RR, Oduyebo T, Tong VT, et al. Update: Characteristics of Symptomatic Women of Reproductive Age with Laboratory-Confirmed SARS-CoV-2 Infection by Pregnancy Status - United States, January 22-October 3, 2020. MMWR Morb Mortal Wkly Rep. 6 nov 2020;69(44):1641‑7.
4. Pregnancy and risk of COVID‐19: a Norwegian registry‐linkage study - Magnus - 2022 - BJOG: An International Journal of Obstetrics & Gynaecology - Wiley Online Library [Internet]. [cité 17 janv 2022]. Disponible sur: https://obgyn.onlinelibrary.wiley.com/doi/10.1111/1471-0528.16969
5. Ellington S, Strid P, Tong VT, Woodworth K, Galang RR, Zambrano LD, et al. Characteristics of Women of Reproductive Age with Laboratory-Confirmed SARS-CoV-2 Infection by Pregnancy Status - United States, January 22-June 7, 2020. MMWR Morb Mortal Wkly Rep. 26 juin 2020;69(25):769‑75.
6. Allotey J, Stallings E, Bonet M, Yap M, Chatterjee S, Kew T, et al. Clinical manifestations, risk factors, and maternal and perinatal outcomes of coronavirus disease 2019 in pregnancy: living systematic review and meta-analysis. BMJ. 1 sept 2020;370:m3320.
7. Villar J, Ariff S, Gunier RB, Thiruvengadam R, Rauch S, Kholin A, et al. Maternal and Neonatal Morbidity and Mortality Among Pregnant Women With and Without COVID-19 Infection: The INTERCOVID Multinational Cohort Study. JAMA Pediatrics. 1 août 2021;175(8):817‑26.
8. Papageorghiou AT, Deruelle P, Gunier RB, Rauch S, García-May PK, Mhatre M, et al. Preeclampsia and COVID-19: results from the INTERCOVID prospective longitudinal study. Am J Obstet Gynecol. sept 2021;225(3):289.e1-289.e17.
9. Wei SQ, Bilodeau-Bertrand M, Liu S, Auger N. The impact of COVID-19 on pregnancy outcomes: a systematic review and meta-analysis. CMAJ. 19 avr 2021;193(16):E540‑8.
10. Stock SJ, Carruthers J, Calvert C, Denny C, Donaghy J, Goulding A, et al. SARS-CoV-2 infection and COVID-19 vaccination rates in pregnant women in Scotland. Nat Med. 13 janv 2022;1‑9.
11. Dagan N, Barda N, Biron-Shental T, Makov-Assif M, Key C, Kohane IS, et al. Effectiveness of the BNT162b2 mRNA COVID-19 vaccine in pregnancy. Nat Med. oct 2021;27(10):1693‑5.
12. https://www.ema.europa.eu/en/documents/rmp-summary/comirnaty-epar-risk-management-plan_en.pdf (page 36)
13. Preliminary Findings of mRNA Covid-19 Vaccine Safety in Pregnant Persons | NEJM https://www.nejm.org/doi/full/10.1056/nejmoa2104983
14. Fell DB, Dimanlig-Cruz S, Regan AK, Håberg SE, Gravel CA, Oakley L, et al. Risk of preterm birth, small for gestational age at birth, and stillbirth after covid-19 vaccination during pregnancy: population based retrospective cohort study. BMJ [Internet]. 2022 Aug 17 [cited 2022 Aug 22];378:e071416. Available from: https://www.bmj.com/content/378/bmj-2022-071416
15. Carlsen EØ, Magnus MC, Oakley L, Fell DB, Greve-Isdahl M, Kinge JM, et al. Association of COVID-19 Vaccination During Pregnancy With Incidence of SARS -CoV-2 Infection in Infants. JAMA Internal Medicine. 2022 Jun 1 [cited 2022 Jun 7]; Available from: https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2793109
16 Halasa NB, Olson SM, Staat MA, Newhams MM, Price AM, Pannaraj PS, et al. Maternal Vaccination and Risk of Hospitalization for Covid-19 among Infants. New England Journal of Medicine. 2022 Jun 22;
17. Yeo KT, Chia WN, Tan CW, et al. Neutralizing activity and SARS-CoV-2 vaccine mRNA persistence in serum and breastmilk after BNT162b2 vaccination in lactating women. Front Immunol. 2022;12:783975 .
18. Perl SH, Uzan-Yulzari A, Klainer H, et al. SARS-CoV-2-specific antibodies in breast milk after COVID-19 vaccination of breastfeeding women. JAMA 2021;325: 2013-4
19. Carcione D, Regan AK, Tracey L, et al. The impact of parental postpartum pertussis vaccination on infection in infants: a population-based study of cocooning in Western Australia. Vaccine. 2015;33(42):5654-5661. doi:10.1016/j.vaccine.2015.08.066 20.
20. Sarah J, Jeffrey CK and al. Maternal mRNA covid-19 vaccination during pregnancy and delta or omicron infection or hospital admission in infants: test negative design study. BMJ 2023; 380 doi: https://doi.org/10.1136/bmj-2022-074035
21. Goh O, Pang D, Tan J, et al. mRNA SARS-CoV-2 Vaccination Before vs During Pregnancy and Omicron Infection Among Infants. JAMA Netw Open. 2023;6(11):e2342475. https://doi.org/10.1001/jamanetworkopen.2023.42475

 Cette FAQ présente de façon simple et didactique les différents aspects concernant les vaccins en général et en particulier les vaccins de la COVID-19. Elle est mise à jour de façon très régulière en fonction des nouvelles connaissances et des nouveaux résultats.
Cette FAQ présente de façon simple et didactique les différents aspects concernant les vaccins en général et en particulier les vaccins de la COVID-19. Elle est mise à jour de façon très régulière en fonction des nouvelles connaissances et des nouveaux résultats.